推荐产品
公司新闻/正文
免疫细胞精细分型和细胞因子检测写进专家共识
632 人阅读发布时间:2024-07-24 13:52
病因和流行病学
自身免疫性脑炎(Autoimmune Encephalitis,AE)是指一类由自身免疫机制介导的脑炎,体液或者细胞免疫反应介导中枢神经系统损伤,肿瘤和前驱感染事件常为AE的诱因。AE患病比例占脑炎病例的 10%~20%,年发病率约为 1/10 万左右。2018 年,AE 被列入我国《第一批罕见病目录》。
·临床表现和分类·
01 前驱症状与前驱事件:抗 NMDAR 脑炎常见发热、头痛等前驱症状。抗 NMDAR 脑炎偶尔可以发生于单纯疱疹病毒(HSV-1)脑炎等中枢神经系统(CNS)病毒感染之后。
02 主要症状:包括精神行为异常、认知障碍、近事记忆力下降、癫痫发作、言语障碍、运动障碍、不自主运动、意识水平下降与昏迷、自主神经功能障碍等。
03 其他症状:睡眠障碍、CNS 局灶性损害、脑干、小脑症状以及周围神经和神经肌肉接头受累等。
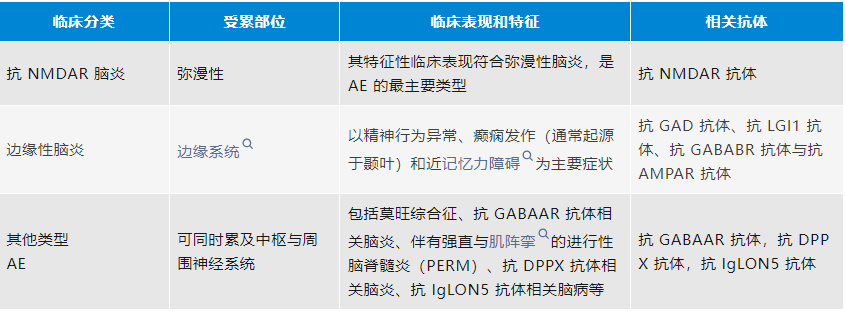
表1.自身免疫性脑炎的分类和临床特征
·诊断流程和标准·
自身免疫性脑炎的诊断首先需要综合分析患者的临床表现、脑脊液检查、神经影像学和脑电图等结果,确定患有脑炎,继而选择AE相关的抗体检测予以诊断。
诊断评估程序见下图:

图1.自身免疫性脑炎的诊断评估程序(2022 版)

图2.自身免疫性脑炎的诊断评估程序(2017 版)
可以看到,与 2017 版专家共识相比,新共识在血液检查项上新增了 ANCA 抗体、淋巴细胞免疫分型、细胞因子等项目的检测。为什么会有这样的变化呢?从下图中我们可以看到多种免疫细胞及细胞因子参与自身免疫性脑炎的发生、发展。
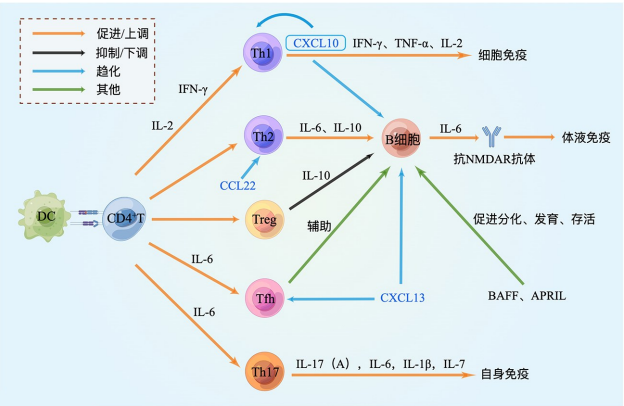
图3. 抗 NMDAR 脑炎相关细胞因子免疫网络
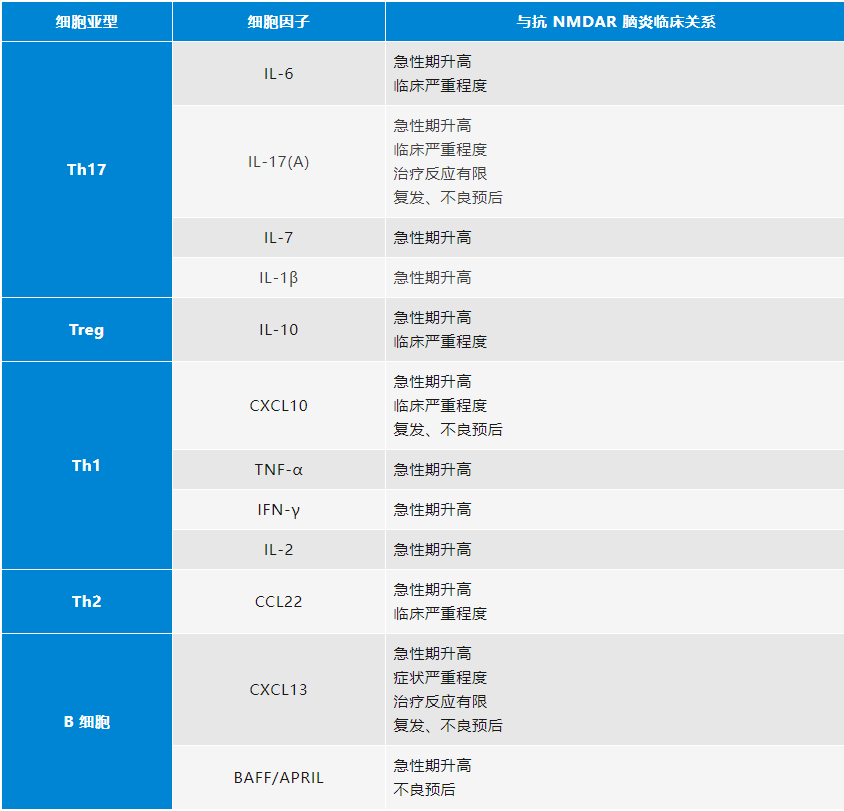
表2.细胞因子反映疾病的活动度及预后等情况
因此,检测患者外周血、脑脊液中的免疫细胞、细胞因子、趋化因子等,可以帮助我们探寻更多的生物标志物来辅助疾病诊断、评估病情和预后,同时也可为免疫靶向治疗提供依据和新靶点。
·生物标志物的探索·
临床上仅基于抗体水平进行诊断和治疗存在一些缺陷,考虑到免疫紊乱在AE发生发展中的重要作用,应用免疫细胞、细胞因子等可以为疾病的诊断和鉴别诊断等提供新的生物标志物。
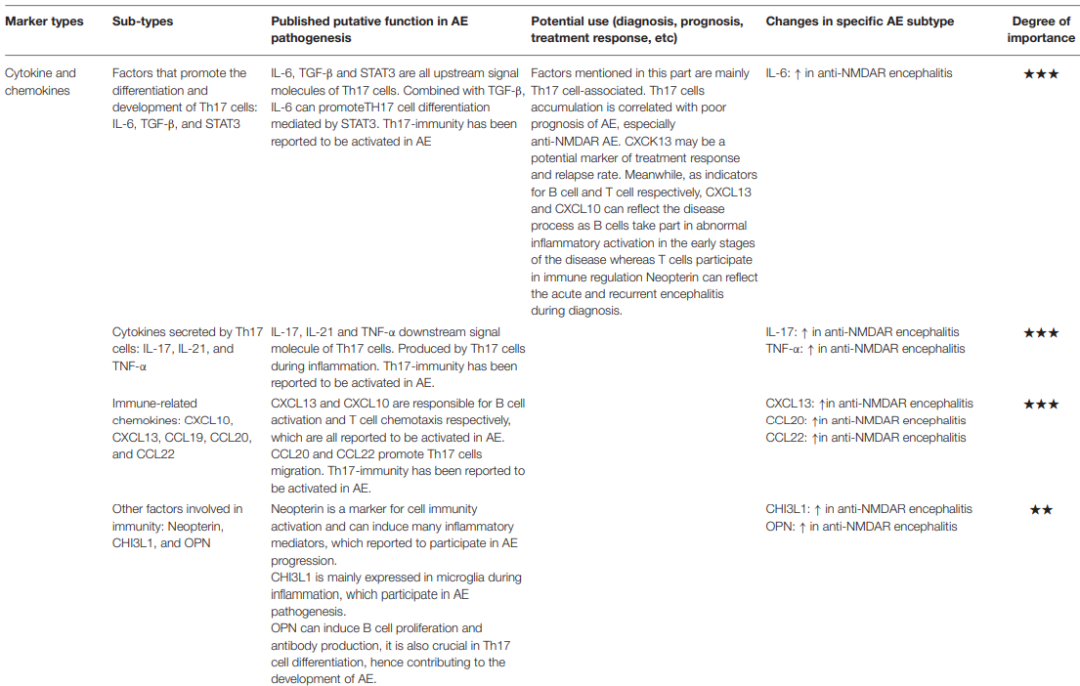
图4:细胞因子和趋化因子可作为潜在的AE诊断生物标志物
·发病机制的研究·
有研究发现,抗 NMDAR 脑炎患者血清中 IL-1a、IL-6、IL-8、IL-13、MCP-1 和 TNF-a 水平显著升高,且 IL-6、IL-8、TNF-a 水平与瓜氨酸化组蛋白 3(H3Cit)水平呈正相关,提示中性粒细胞胞外陷阱 (NETs) 可能在抗 NMDAR 脑炎中发挥作用。因此检测细胞因子有助于深入研究自身免疫性脑炎的发病机理。
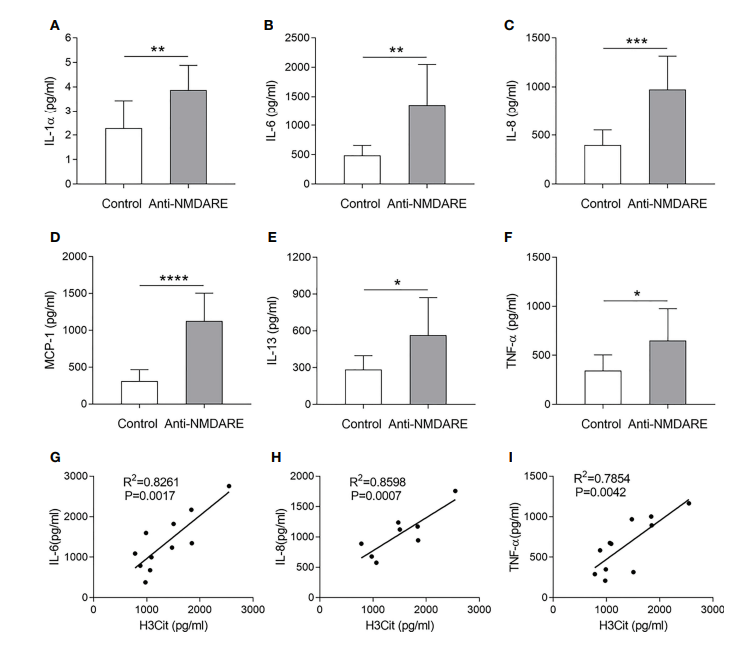
图5:抗 NMDAR 脑炎血清细胞因子的变化
·辅助疾病的鉴别·
脑脊液中的细胞因子和趋化因子作为活动性神经炎症的诊断生物标志物,在区分急性播散性脑脊髓炎(ADEM)、不同自身免疫性脑炎和病毒脑炎方面具有一定的作用。
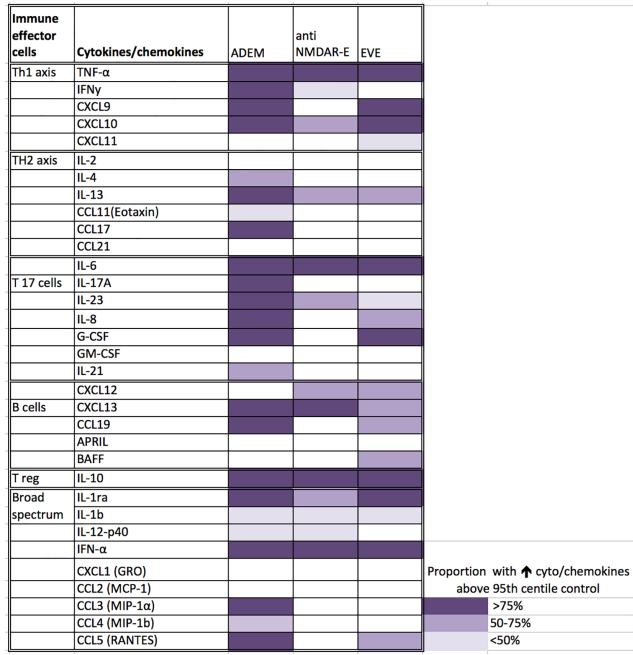
图6. 不同脑炎患者脑脊液细胞因子/趋化因子升高的热图
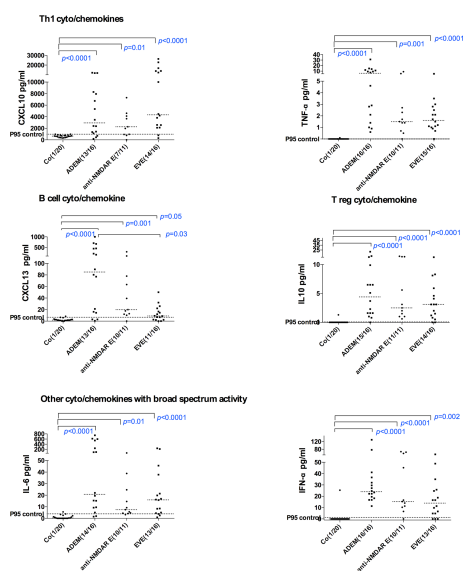
图7. ADEM、抗 NMDARE、EVE 不同脑炎患者脑脊液细胞因子的差异
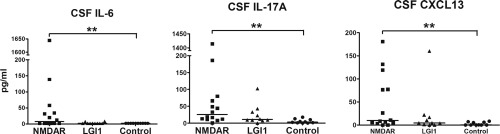
图8. 抗 NMDAR 和抗 LGI1 脑炎患者细胞因子/趋化因子水平的差异
·复发风险的预测 ·
外周血免疫细胞水平的波动与 AE 的复发存在相关性,CD4+T、CD8+T 和 B 细胞水平的波动在一定程度上能预测AE的复发,其中免疫细胞亚群的动态变化即数值升高幅度相较于单次检测数值更具有明显预测意义。有研究显示外周血 CD19+B 细胞升高幅度大于 73.5个/μL 时,预测 AE 患者复发的特异性和敏感性分别为 69.2% 和 86.7%;CD19+B 细胞升高幅度大于 106.5个/μL 时,预测复发的敏感度为 53.8%,特异度为 90.0%。
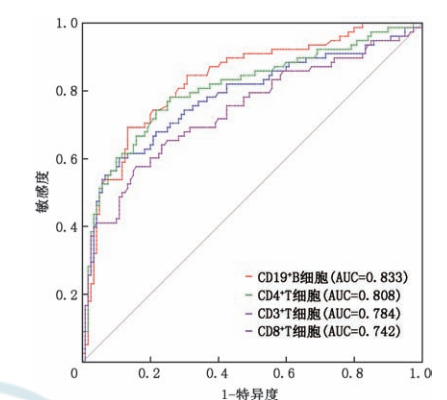
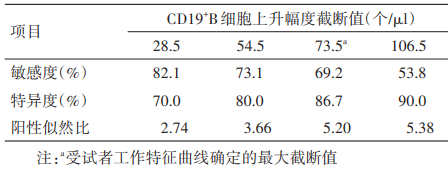
图9. 外周血免疫细胞水平预测AE复发
·AE 的治疗监测·
AE 的治疗包括免疫治疗、对癫痫发作和精神症状等的症状治疗、支持治疗和康复治疗。对合并肿瘤者进行切除肿瘤等抗肿瘤治疗。
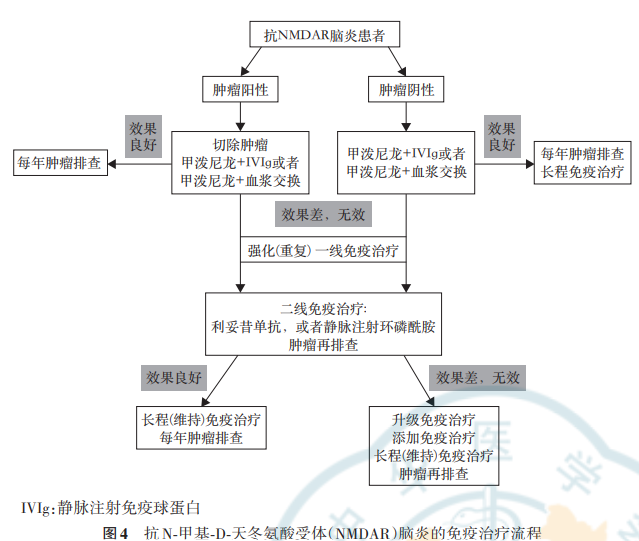
图10. 抗 NMDAR 脑炎的免疫治疗流程
·评估免疫治疗疗效及指导个体化治疗方案·
接受免疫治疗的 AE 患者建议定期监测外周血免疫细胞亚群的变化。其中 CD19+B 细胞一方面可以评估抗 CD20 药物利妥昔单抗的疗效;另一方面,研究显示接受利妥昔单抗进行维持免疫治疗的 AE 患者,当其外周血 CD19+ B 细胞由 0 个 /μL 恢复至 20~30 个 /μL 时,提示有复发的风险,临床可根据患者病情和其它检测结果再次给予利妥昔单抗治疗。
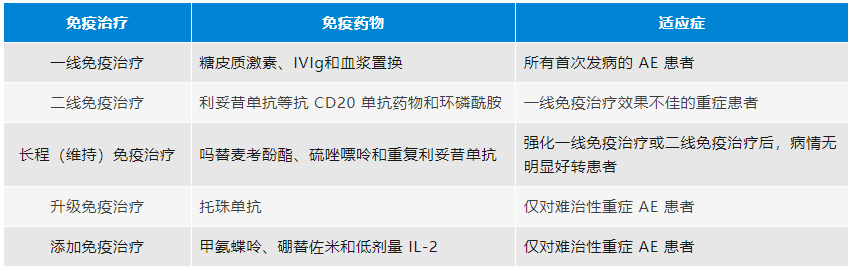
表3. AE 的免疫治疗方案
写到最后
人体免疫系统紊乱导致自身抗体异常,穿透血脑屏障到达中枢神经系统引起自身免疫性脑炎。临床医生常形容自身免疫性脑炎是大脑“着火”了,我们从脑脊液和外周血炎症细胞和炎症因子的结果上也能感受到风风“火火”。流式细胞仪检测免疫细胞和细胞因子检测项目的普及,可以帮助我们找到“火源”、看清和控制“火情”。
最后,梅雨季节,祝愿各位看官神清气爽。
此文仅供科普,对患者的临床诊治应结合其症状/体征、病史、其它实验室检查及治疗反应等情况综合考虑。
参考资料:
1. 中华医学会神经病学分会神经感染性疾病与脑脊液细胞学学组. 中国自身免疫性脑炎诊治专家共识(2022年版) [J] . 中华神经科杂志, 2022, 55(9) : 931-949.
2. 中华医学会神经病学分会. 中国自身免疫性脑炎诊治专家共识[J]. 中华神经科杂志,2017,50(2):91-98.
3. 郑雅心,蒋莉. 抗N-甲基-D-天冬氨酸受体脑炎相关细胞因子的研究进展[J]. 中国当代儿科杂志, 2023, 25(3): 321-327.
4. Zhang S, Mao C, Li X, Miao W, Teng J. Advances in Potential Cerebrospinal Fluid Biomarkers for Autoimmune Encephalitis: A Review. Front Neurol. 2022 Jul 22;13:746653.
5. Qiao S, Sun QY, Zhou P, Zhang SC, Wang ZH, Li HY, Wang AH, Liu XW, Xin T. Increased formation of neutrophil extracellular traps in patients with anti-N-methyl-d-aspartate receptor encephalitis. Front Immunol. 2022 Dec 8;13:1046778.
6. Kothur K, Wienholt L, Mohammad SS, et al. Utility of CSF Cytokine/Chemokines as Markers of Active Intrathecal Inflammation: Comparison of Demyelinating, Anti-NMDAR and Enteroviral Encephalitis. PLoS One. 2016 Aug 30;11(8):e0161656.
7. Byun JI, Lee ST, Moon J, Jung KH, Sunwoo JS, Lim JA, Kim TJ, Shin YW, Lee KJ, Jun JS, Lee HS, Lee WJ, Kim YS, Kim S, Jeon D, Park KI, Jung KY, Kim M, Chu K, Lee SK. Distinct intrathecal interleukin-17/interleukin-6 activation in anti-N-methyl-d-aspartate receptor encephalitis. J Neuroimmunol. 2016 Aug 15;297:141-7.






