推荐产品
公司新闻/正文
应用简报:利用安捷伦Seahorse实时细胞能量代谢分析评估 T 细胞的生物能量代谢平衡和备用呼吸能力
927 人阅读发布时间:2024-09-05 10:40

摘要
安捷伦 Seahorse XF T细胞代谢分析试剂盒是一款能实时全面评估 T细胞代谢的强大解决方案。代谢已经逐渐被认为是细胞命运和功能的关键驱动因素。研究表明,T细胞的代谢重编程可以作为一种提高过继性 T细胞疗法抗肿瘤有效性的策略。XF T细胞代谢分析试剂盒支持同时测量 T 细胞群中的糖酵解和线粒体活性,并测量线粒体呼吸能力。这些参数与 T细胞疗法的最佳功能和更高持久性有关。以前,使用 FCCP测量线粒体呼吸能力需要针对不同细胞类型、分化阶段、供体和健康或疾病状态进行浓度优化。XF T 细胞代谢分析试剂盒使用了一种改进的解偶联剂 (BAM15),能够使 T细胞生物能量代谢能力的测量结果更一致、更准确,且相比 FCCP 需要更少的浓度优化。此外,本应用简报重点介绍了根据 XF T细胞持久性检测工作流程,使用该试剂盒评估培养基成分对 T细胞扩增过程的影响。该工作流程支持同时评估糖酵解和线粒体呼吸的活性及能力,提供 T细胞的全面代谢分析,可用于监测和改进T细胞疗法的设计和开发。
前言
细胞介导免疫疗法的发展已彻底改变了癌症研究和免疫系统研究。一种很有前景的细胞疗法涉及靶向癌细胞的新型嵌合抗原受体 (CAR) T细胞的基因工程改造。有充分证据表明,T细胞的代谢特性,即 T细胞如何维持生物能量代谢需求,在调节其抗肿瘤功能和决定 T细胞免疫疗法的有效性中发挥重要作用[1]。
T细胞在活化和分化为效应细胞和记忆细胞的过程中会发生一系列的代谢表型变化,这些变化对维持 T细胞的功能至关重要[2]。初始 T细胞处于静止状态,代谢需求低,主要由线粒体呼吸维持。抗原刺激诱导静止状态改变,营养吸收加快,合成代谢增强,线粒体代谢发生重编程。这些代谢变化对于支持 T细胞快速增殖和分化以产生引发细胞毒性的细胞因子或分子至关重要。在成功清除抗原刺激后,剩余的分化记忆 T细胞恢复到更安静的表型,主要表现为线粒体呼吸活性和高备用呼吸能力 (SRC)。在长期刺激或代谢抑制环境下,T细胞会出现代谢功能障碍 ———— 一种称为 T细胞耗竭的状态,此时 T细胞显示出线粒体生物能量代谢能力和效应功能的下降(图 1)。
由于代谢调节对 T细胞命运和功能的重大影响,确定 CAR-T和其他过继性 T细胞疗法的代谢特征能够在定 T细胞持久性和抗肿瘤功能中发挥关键作用。此外,对 T细胞的代谢途径进行调节或重编程可以作为一种提高 T细胞抗肿瘤有效性的策略。
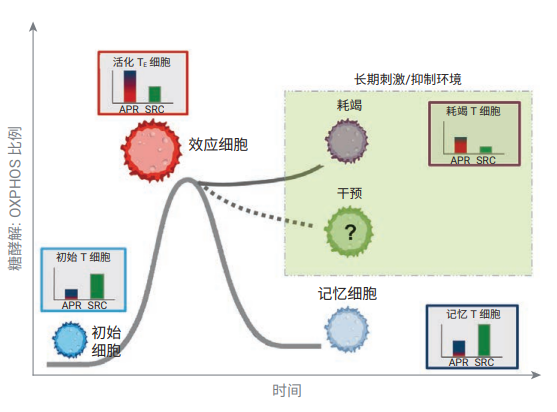
图 1. T 细胞能量代谢的基本原理和 T 细胞代谢表型的测量,展示了糖酵解/OXPHOS 比例与细胞命运、适应性和功能之间的关系。在长期刺激或抑制物存在的环境下(如肿瘤微环境),T细胞可发展为耗竭表型,且线粒体功能受损
T细胞寿命不同阶段的糖酵解和线粒体生物能量代谢途径的完整表征,以及关于对不同细胞环境或应激信号的代谢适应信息,是优化 T细胞疗法和提高免疫治疗产品抗肿瘤效力的关键。安捷伦 Seahorse XF 技术旨在同时分析活细胞中糖酵解和线粒体的功能,是用于研究免疫细胞代谢的前沿平台,也是当前理解 T细胞活化和分化过程中免疫代谢及代谢改变重要作用的主要贡献者之一[3,4]。
本应用简报介绍了全新安捷伦 Seahorse XF T细胞代谢分析试剂盒,该试剂盒旨在对 T细胞群的糖酵解和线粒体活性,以及线粒体呼吸能力进行同步可靠测量。这些测量通过单次检测提供了 T细胞代谢特性的完整表征,且可与 T细胞治疗产品抗肿瘤功能的增强或减弱相关联。针对提高肿瘤微环境中T细胞持久性或避免出现活化后代谢耗竭的疗法开发过程而言,获得这些测量结果尤其重要。
用于 T 细胞中的线粒体解偶联剂性能综述
结合使用安捷伦 Seahorse XF 细胞线粒体压力测试和安捷伦 Seahorse XF 分析仪的 T 细胞线粒体功能研究,为 T 细胞能量代谢及其在指导 T 细胞命运和功能中的作用提供了基础知识[3,4]。安捷伦 Seahorse XF 细胞线粒体压力测试试剂盒结合了一系列试剂,可实现线粒体功能的完整表征。特别是,依次注入 ATP 合成酶抑制剂(寡霉素)、线粒体解偶联剂(羰基氰-对-(三氟甲氧基)苯腙,FCCP)和线粒体抑制剂(鱼藤酮和抗-霉素 A 混合物 (rot/AA))可实现在完整细胞中计算与 ATP产生偶联的氧气消耗速率(ATP 关联呼吸)和非偶联的最大呼吸及备用呼吸能力 (SRC),即基础呼吸和最大呼吸能力之间的差值。这些参数已广泛应用于不同 T 细胞群线粒体功能的表征,并用来描述提高 T 细胞抗肿瘤功能的过程[5-7]。然而,尽管该方法在免疫代谢领域被大量采用,但它在 T 细胞中的应用仍存在一些困难,主要由于使用了质子载体解偶联剂 FCCP。
有几个原因导致 FCCP 与 T 细胞(可能还有其他免疫细胞)一起使用的效果并不理想。其一,FCCP 的最佳浓度取决于多种因素,包括免疫细胞类型、分化阶段、供体和疾病状态。如果没有针对每个实验对其浓度进行滴定或优化,就会导致对最大呼吸能力的低估。其二,在初始 T 细胞和其他某些分化的T 细胞中,暴露于 FCCP 后的耗氧率 (OCR) 是不稳定的,导致测量结果差异很大,并可能低估最大呼吸能力。
此外,在 XF 细胞线粒体压力测试中使用 FCCP 限制了该测试定量测量糖酵解活性(即糖酵解 ATP (glycoATP) 生成速率)的能力。利用 Seahorse XF ECAR(细胞外酸化率)测量值计算 glycoATP 的产生速率时,需要对利用基础 OCR 测量值和添加 rot/AA 后的 OCR 估计的 CO2 贡献量进行校正[8]。然而,当 FCCP 在添加 rot/AA 之前使用时,可能会使 CO2 贡献量被低估,并影响糖酵解活性的定量。这在高度氧化的细胞中尤为重要,即主要依赖线粒体氧化磷酸化 (OXPHOS) 获得能量的细胞,其中 CO2 对 ECAR 的贡献量不能忽视。
同时评估线粒体 ATP (mitoATP) 产生速率和 glycoATP 产生速率可以表征细胞的基础能量需求(即总细胞 ATP 产生速率)和基础代谢平衡(即 glycoATP 和 mitoATP 产生速率之比)。这些是决定 T 细胞命运和功能的关键参数。然而,它们无法由XF 细胞线粒体压力测试提供,导致了 T 细胞生物能量代谢的不完全表征。
全新安捷伦 Seahorse XF T 细胞代谢分析试剂盒的开发
为能同时获得 T 细胞群糖酵解和线粒体活性准确、一致的定量生物能量代谢测量结果,安捷伦开发了 Seahorse XF T 细胞代谢分析试剂盒。该试剂盒可通过解偶联剂 BAM15 准确测量T 细胞的最大呼吸能力。BAM15 是一种新型解偶联剂,其效力与 FCCP 相似,但细胞毒性更小,对质膜的亲和力更低,因此具有更广泛的应用范围[9]。
如图 2A 到 2C(红线)所示,使用 XF 细胞线粒体压力测试试剂盒测试初始 T 细胞时,添加 FCCP 后,仪器测量的三分钟内O2 浓度的变化速率不是恒定或线性的,这导致了 OCR 计算的误差,并低估了最大呼吸(图 2D 到 2F,红线)。此外,比较添加 FCCP 和溶剂得到的动力学曲线(图 2D,红色或蓝色曲线)可以看出,在添加 rot/AA 后,OCR 可能被明显高估。而在使用解偶联剂 BAM15 替代 FCCP 后,添加 BAM15 后 OCR得到了稳定的增加(图 2A 到 2C,绿线),实现了精准的最大呼吸测定(图 2D 到 2F,绿线)。
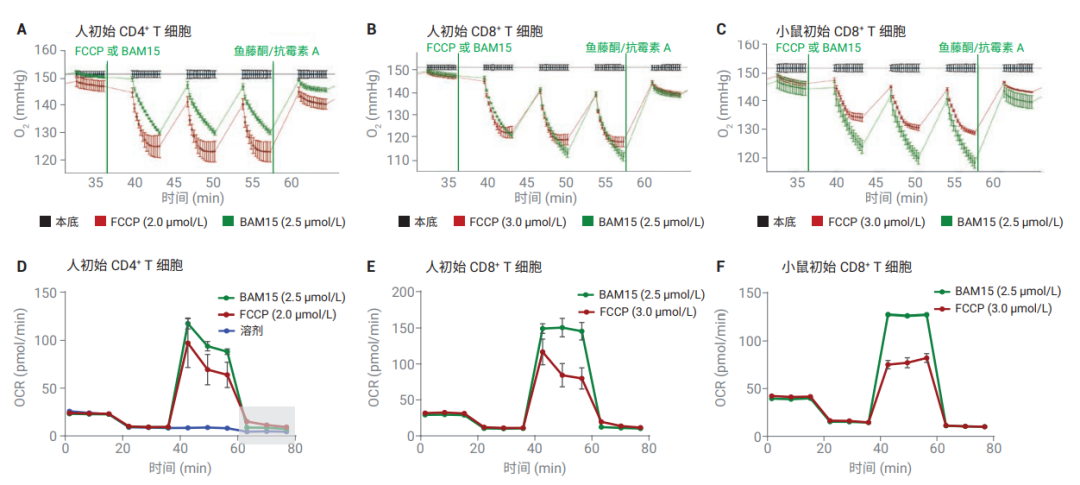
图 2. 比较使用解偶联剂 FCCP 和 BAM15 的耗氧量测量结果。所有细胞以 2 × 106 细胞/孔接种于 Seahorse XF RPMI 分析培养基中 (pH 7.4),补充 10 mmol/L 葡萄糖、2 mmol/L 谷氨酰胺和 1 mmol/L 丙酮酸钠。添加最佳浓度解偶联剂 FCCP(红线)或 BAM15(绿线)后,初始人 CD4+ (A)、初始人 CD8+ (B) 和小鼠脾源 CD8+ T 细胞 (C)细胞外氧含量的变化。初始人 CD4+ (D)、初始人 CD8+ (E) T 细胞和小鼠脾源 CD8+ T 细胞 (F) 通过 XF 细胞线粒体压力测试(红线)或 T 细胞代谢分析试剂盒检测(绿线)获得的耗氧率 (OCR)。2D 中的蓝线代表添加了检测液,而非解偶联剂
在这些初步测试后,还进行了其他实验,使用人初始 CD4+、人初始 CD8+、人 PBMC 和小鼠脾源 CD8+ T 细胞,每种细胞类型至少来自三个不同的供体。在所有条件下,均使用 FCCP或 BAM15 进行平行滴定。与在最佳 FCCP 浓度下获得的结果相比,以 BAM15 作为解偶联剂得到的最大呼吸更高,标准偏差更低(图 3A 到 3C)。滴定实验还表明,BAM15 的最佳浓度范围比 FCCP 的最佳浓度范围更宽,这说明在使用 BAM15时,不需要对每个样品都优化解偶联剂浓度(图 3A 和 3B,中间柱状图)。
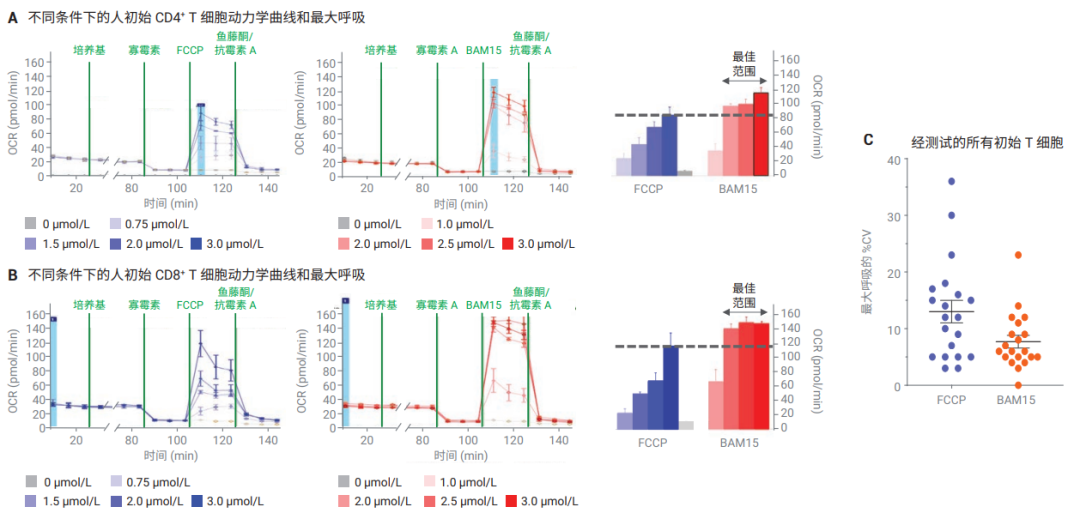
图 3. 比较使用人初始 CD4+ T 细胞 (A) 和人初始 CD8+ T 细胞 (B) 的 FCCP 和 BAM15 滴定实验的最大呼吸测量结果。中间的柱状图代表在不同解偶联剂浓度下获得的最大呼吸。(C) 在使用最佳浓度 FCCP 或 2.5 µmol/L BAM15 时,得到的初始 T 细胞组的最大呼吸 %CV
另外,还将使用 XF T 细胞代谢分析试剂盒(配备 BAM15 解偶联剂)计算得到的 glycoATP 产生速率和使用安捷伦 Seahorse XF实时 ATP 速率测定试剂盒得到的结果进行了比较。结果表明,从这两种试剂盒或测定中得到的基础 glycoATP 产生速率没有显著差异(图 4)。
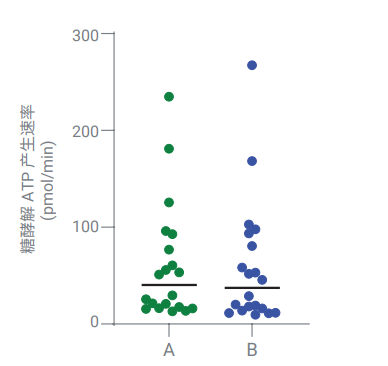
图 4. 比较了在添加寡霉素和 rot/AA 之间,使用安捷伦 Seahorse XF 实时 ATP速率测定试剂盒 (B) 或 XF T 细胞代谢分析试剂盒 (A) 计算得到的 T 细胞的基础glycoATP 产生速率(以 BAM15 为解偶联剂)
最后,选择多种 T 细胞用于进一步评估 XF T 细胞代谢分析试剂盒,来源从人类到小鼠,包括不同供体和分化状态。进行了滴定实验,将最佳 FCCP 浓度下获得的最大 OCR 值与单浓度 BAM15 (2.5 µmol/L) 得到的多种 T 细胞的 OCR 值进行了比较(图 5)。在所有条件下,同一细胞类型中使用 2.5 µmol/LBAM15 获得的最大 OCR 值至少是在最佳 FCCP 浓度下获得的最大 OCR 值的 90%。使用 2.5 µmol/L BAM15 获得的最大OCR 值比最佳 FCCP 浓度下获得的 OCR 值平均高 20%,这表明试剂盒中的固定浓度 2.5 µmol/L 的 BAM15 试剂可用于所有类型的 T 细胞,或仅需要极少优化。
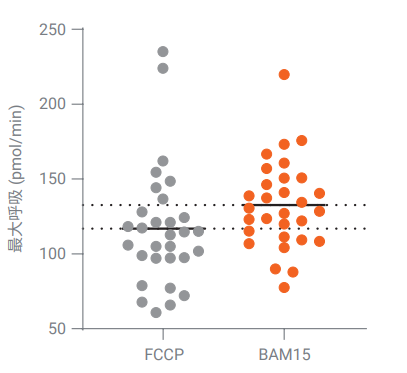
图 5. 比较在最佳 FCCP 浓度或 2.5 µmol/L BAM15 时各种 T 细胞的最大呼吸,包括人 PBMC、初始 CD4+、初始 CD8+、活化 CD4+、活化 CD8+、效应 CD8+、记忆 CD8+ T 细胞和小鼠初始及活化 CD8+ T 细胞(每种细胞类型的 n = 3)
XF T 细胞代谢分析试剂盒在优化 T 细胞治疗产品持久性中的应用
在评估 CAR-T 和其他过继性 T 细胞疗法时,需要考虑的一个关键属性是细胞的代谢特征,因为它在决定 T 细胞持久性和抗肿瘤功能中起至关重要的作用。据报道,在体外扩增过程中获得高代谢活性效应表型的 CAR-T 细胞在体内表现出较差的持久性和抗肿瘤活性。然而,在体外扩增过程中表现出低到中等代谢活性和高备用呼吸能力的 CAR-T 细胞则具有良好的抗肿瘤免疫功能,表现为更强的增值能力、更高的肿瘤细胞杀伤速率及细胞因子产生速率[10]。有研究表明,生产过程中的不利扩增条件可能会产生不良代谢表型的 T 细胞产品,进而导致体内效力降低。这些研究还指出,T 细胞在扩增过程中的代谢调节可以诱导代谢重编程,从而延长体内持久性并增强抗肿瘤功能[5,11,12]。
XF T 细胞代谢分析试剂盒旨在协助 T 细胞疗法的开发,仅一次检测即可提供 T 细胞代谢特性的完整信息,包括总的基础能量需求、基础代谢平衡和备用呼吸能力,所有参数都曾被用以描述持久性增加或降低的 T 细胞代谢状态[10]。因此,它是评估和优化 T 细胞扩增条件的理想选择,从而得到所需的 T 细胞持久性更好的代谢表型。
下面的研究中,使用 XF T 细胞代谢分析试剂盒评估了不同细胞培养基成分(含 10 mmol/L 葡萄糖 + 10% FBS 的RPMI 或ImmunoCult XF 培养基 (STEMCELL Technologies))和不同白介素(IL-2 或 IL-15)添加对 T 细胞产品代谢的影响。以往的研究表明,与 IL-2 中培养的细胞相比,IL-15 中扩增的细胞具有更低的分化表型[13]。在本研究中,用 CD3/CD28 抗体偶联
的磁珠活化来自不同健康人类供体的 pan T 细胞。三天后将磁珠去除,细胞在指定的培养基条件下扩增(图 6)。将细胞以1 × 106 细胞/mL 的密度培养,每三天更新一次培养基并调整容量。在第 7、14、22 天取样,在建议的检测条件下,使用XF T 细胞代谢分析试剂盒进行 XF T 细胞持久性检测[14]。首先,比较了细胞扩增过程中的 SRC。如图 6A 所示,在第7 天观察到在 IL-15 或 IL-2 中扩增细胞的 SRC 差异,这与扩增使用的细胞培养基无关。在第 22 天,IL-15 中扩增细胞的SRC 增加变得明显,尤其是在优化的 ImmunoCult XF 培养基中培养的细胞(图 6C)。高 SRC 是记忆样表型的特征,此前被认为与高持久性有关。
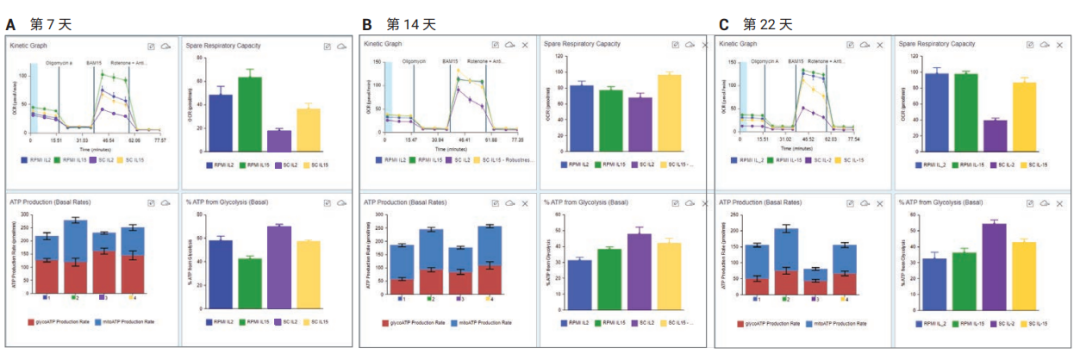
图 6. 细胞扩增条件对 T 细胞代谢测量的影响。在 ImmunoCult XF T 细胞扩增培养基中用 Dynabeads 人活化剂 CD3/CD28 活化人外周血 pan T 细胞,并在 5% CO2 的培养箱中,于 37 °C 条件下培养。活化两天后,去除 Dynabeads,将细胞分为 4 组,按 1 × 106 细胞/mL 重悬于以下 4 种培养基中:蓝色 ― RPMI 添加 2 mmol/L 谷氨酰胺、10% FBS 和 IL-2 (300 U/mL);绿色 ― RPMI 添加 2 mmol/L 谷氨酰胺、10% FBS 和 IL-15 (10 ng/mL);紫色 ― ImmunoCult XF 培养基添加 IL-2 (300 U/mL);黄色 ― ImmunoCult XF 培养基添加 IL-15 (10 ng/mL)。在活化后第 7 天、14 天和 22 天采集样品并分析。每天报告的数据包括 OCR 动力学曲线(左上)、SRC(右上)、ATP 产生速率(左下)和糖酵解产生的 ATP 百分比(右下)
下一步是分析该方法得到的额外数据,即糖酵解和线粒体的基础 ATP 产生速率,以更好地表征和改善扩增条件(图 6,每张插图的下两图)。与在含 IL-2 的 ImmunoCult XF 培养基中扩增的细胞相比,在含 IL-15 的培养基中扩增的细胞具有更好的氧化代谢平衡,即糖酵解产生的 ATP 占比更低(图 6,每张插图的右下图,黄色和紫色的柱)。此外,无论使用哪种白介素,与在 ImmunoCult XF 培养基中扩增和分化的细胞相比,在 RPMI 培养基中扩增和分化的细胞都具有更高的代谢需求,即总基础 ATP 产生速率更高(图 6,每张插图左下图)。高代谢需求与效应 T 细胞表型相关。事实上,在使用 AgilentNovoCyte Advanteon 流式细胞仪分析 CCR7-A 和 CD45RO-A表面标志物时,观察到与效应记忆表型为主的 RPMI 中扩增的细胞相比,在 ImmunoCult XF 培养基中扩增的细胞中CCR7-A+/CD45RO-A+ 中央记忆群的比例更高(图 7)。
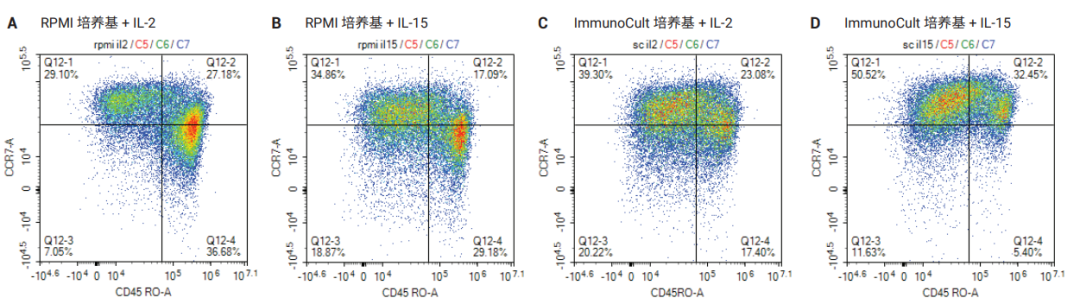
图 7. 在第 22 天,对不同培养基中扩增的样品细胞表面标志物 CCR7-A 和 CD45RO-A 进行流式细胞分析,如图所示。RPMI 培养基中也添加了 2 mmol/L 谷氨酰胺和10% FBS
结论
本文档介绍了 T 细胞代谢特性完整表征的优化方法。该方法结合了 XF 分析仪和 XF T 细胞代谢分析试剂盒,提供了优化的解偶联剂,实现了对 T 细胞最大呼吸和备用呼吸能力的可靠测量,且仅需极少的解偶联剂浓度优化。此外,该方法能使用户获得同一细胞样品糖酵解活性的定量信息以及提供对细胞基础能量需求的独特测量。
为提高开发 T 细胞疗法和预测其疗效的能力,需要结合使用多种工具和正交的检测方法,为表征 CAR-T 细胞治疗产品提供全面的数据集。T 细胞的代谢特征显然是提高 T 细胞产品的持久性和抗肿瘤效力所需要分析的关键属性之一。XF T 细胞持久性检测实现了多参数结果的同时输出,能提供同一样品T 细胞代谢特性的完整表征,并可作为一种用于优化 T 细胞衍生疗法设计和生产的常规方法。
参考文献
1.Chang C. H.; Pearce, E. L. Nature Immunology 2016, 17,364–368.
2. Sukumar et al. Current Opinion in Immunology 2017, 46, 14–22.
3. Wei et al. Frontiers in Immunology 2021, 12, 717014.
4. Voss et al. Nature Reviews Immunology 2021, 21, 637–652.
5. Geiger et al. Cell 2016, 167, 829–842.
6. Kawalekar et al. Immunity 2016, 44, 380–390.
7. Scharping et al. Immunity 2016, 45, 374–388
8. Natalia, R. Quantifying Cellular ATP Production Rate Using Agilent Seahorse XF Technology(使用安捷伦 Seahorse XF 技术定量分析细胞 ATP 产生速率),安捷伦科技公司白皮书,出版号 5991-9309EN
9. Kenwood et al. Molecular Metabolism 2014, 3, 114–123
10. Rostamian et al. Cancer Letters 2021, 500, 107–118.
11. Hermans et al. PNAS 2020, 117(11), 6047–6055.
12. Geltink et al. Nature Metabolism 2020, 2, 703–716.
13. Alizadeh et al. Cancer Inmunol. Res. 2019, 7(5), 759–772.
14. Agilent Seahorse XF T Cell Metabolic Profiling Kit User Guide(安捷伦 Seahorse XF T 细胞代谢分析试剂盒用户指南),安捷伦科技公司,出版号 5994-3493EN
仅供科研使用,不用于临床诊断用途。






