推荐产品
公司新闻/正文
流例说——聊聊 MDS 的流式检测和分析的那些事儿
893 人阅读发布时间:2024-11-20 13:56
在上一期的“金秋九月,邀您浏览这些图,一起拿捏流式在血液疾病中的应用”中和各位流式小主分享了流式细胞术在血液疾病中的应用,这期我们一起聊聊 MDS 的流式检测的那些事儿。
Part 1 骨髓异常综合征(myelodysplastic syndromes,MDS)
疾病概述:MDS 是一组克隆性造血干细胞疾病,2022 版 WHO 将其改名为骨髓增生异常肿瘤。MDS 特点是髓系细胞发育异常,表现为无效造血、难治性血细胞减少以及高风险向急性髓系白血病(AML)转化。MDS 在老年男性和曾接受过细胞毒性治疗的个体中更常见。
疾病诊断:骨髓增生异常综合征中国诊断与治疗指南(2019 年版)指出,MDS 的诊断依赖骨髓细胞分析中细胞发育异常的形态学表现、原始细胞比例升高和细胞遗传学异常,需要联合多种实验室检测技术的综合判断,其中骨髓穿刺涂片细胞形态学和细胞遗传学检测技术是 MDS 诊断的核心。

图 1. MDS 的主要诊断技术
骨髓流式细胞术检查:从图 1 中可以看到骨髓流式细胞术检查是 MDS 诊断的推荐检测项目。虽然流式细胞术不能单独确定 MDS 的诊断,但对于 MDS 的预后、低危 MDS 与非克隆性血细胞减少症的鉴别诊断有重要的应用价值。对于无典型形态学和细胞遗传学证据、无法确诊 MDS 的患者,流式免疫分型的结果可作为辅助诊断标准之一。

图 2. MDS 流式免疫分型检测常用抗体
Part 2
那么问题来了,我们在流式检测 MDS 的时候看什么?MDS 免疫表型异常是什么以及有哪些呢?我们又如何判断以及可以给临床提供哪些信息呢?来,一起解开这些疑惑吧。
01 看原始细胞的数量和抗原表达
正常骨髓中原始细胞比例不高于 5%,且呈散在分布,CD34+ 细胞多数情况下不高于 2%,且 CD34 的表达多呈非聚集性。另外,正常的髓系和红系在分化成熟过程中具有特定的抗原表达模式,而 MDS 患者的造血细胞抗原表达模式常出现异常变化,多色流式细胞术免疫表型分析可以评估与正常髓系、单核细胞和红细胞成熟相关的抗原异常变化,从而辅助 MDS 的临床诊断。
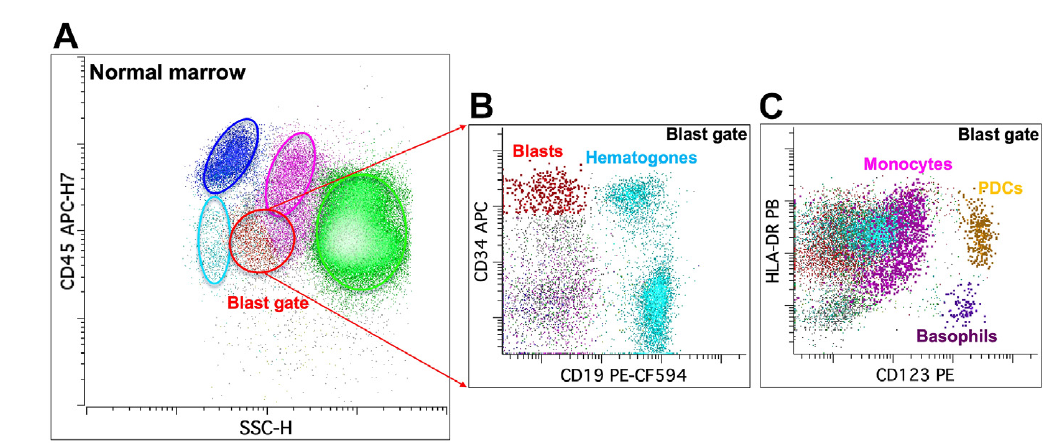
图 3. 骨髓样本流式图
(A) CD45/SSC:成熟淋巴细胞、单核细胞、成熟粒细胞、髓系原始细胞和前体 B 淋巴细胞
(B) CD34/CD19:髓系原始细胞和前体 B 淋巴细胞
(C) HLA-DR/CD123:嗜碱性粒细胞、浆细胞样树突状细胞 pDC 和单核细胞
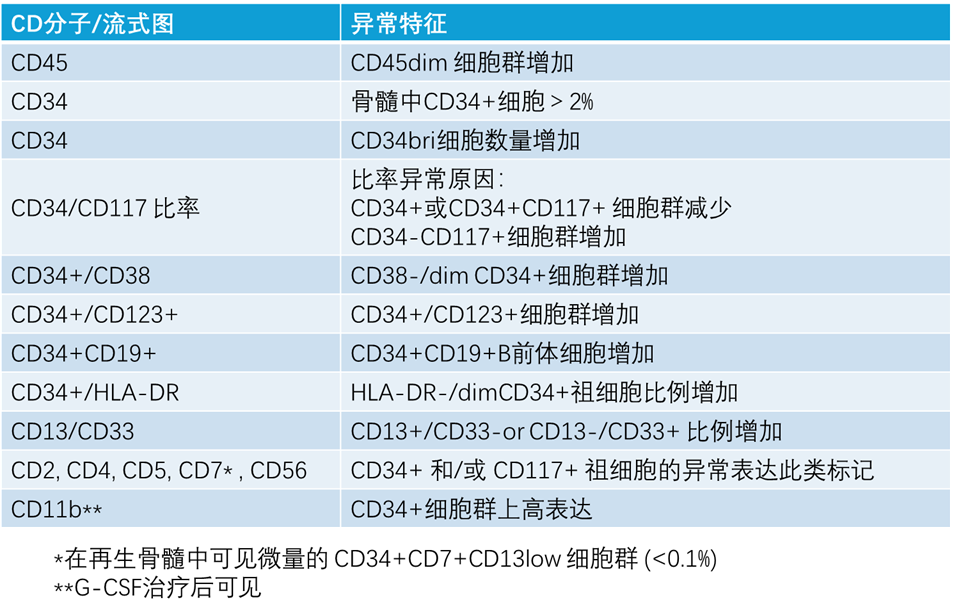
图 4. MDS 骨髓样本原始细胞常见的异常表型
02 看粒细胞的抗原表达和分化轨迹
粒细胞的分化分为 5 个阶段,即原始粒细胞、早幼粒细胞、中幼粒细胞、晚幼粒细胞及杆状和分叶核粒细胞,具有经典的流式分化轨迹。MDS 患者成熟粒细胞常见的抗原表达和分化异常主要包括:非同步表达早期抗原(CD34、CD117、HLA-DR 等);表达淋系抗原(CD7、CD56 等);分化规律异常(CD13/CD16、CD13/CD11b 分化模式异常);CD10+ 粒细胞减少等。另外,MDS 患者粒细胞脱颗粒是形态学粒系病态的一个主要表现,在 FCM 检测 CD45/SSC 图中常表现为 SSC 信号降低。
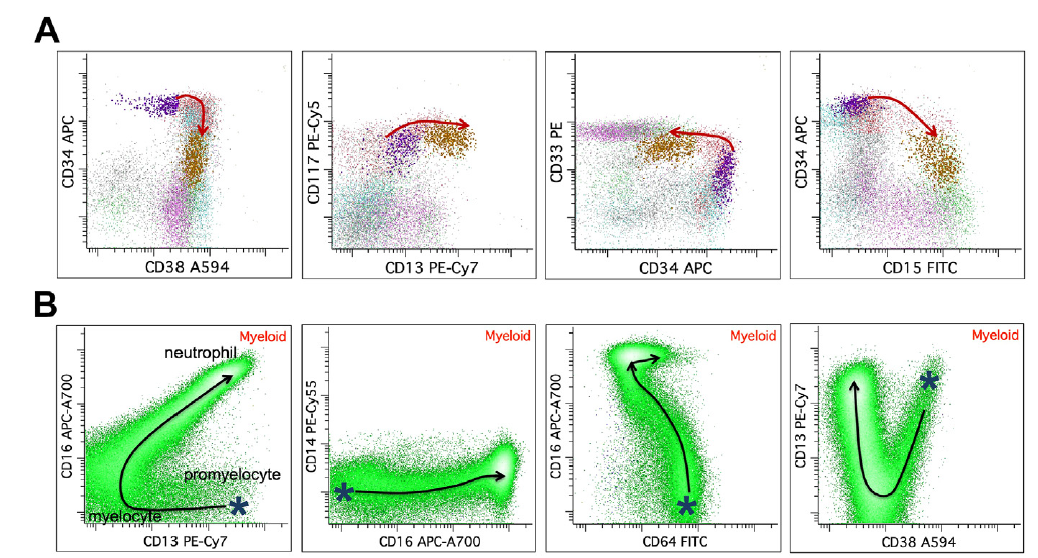
图 5. 正常骨髓粒细胞分化发育模式图
A:原始粒细胞到早幼粒;B:早幼粒到中性粒细胞

图 6. MDS 骨髓样本成熟粒细胞常见的异常表型
03 看单核细胞的抗原表达和分化轨迹
MDS 患者可表现为单核细胞数量减少或增多,且以幼稚单核细胞增高为主。正常单核细胞表达 CD14、CD64、CD33、CD11b 和 HLA-DR。MDS 患者单核细胞的异常主要包括:单核细胞百分比增加或减少;SSC 信号降低;单核细胞正常表达的抗原包括 CD13、CD14、CD15、CD33、CD45、CD64 和 HLA-DR 表达强度异常;CD14 和/或 CD300e 表达减少;成熟单核细胞比例减少;单核细胞跨系表达如 CD5、CD7、CD19 和 CD56 等淋系抗原。MDS 中单核细胞的评估包括单核细胞定量、CD13 和 CD56 的表达以及 HLA-DR/CD11b 的表达模式,这些指标已被证明与 MDS 或 MDS/MPN 的诊断有关。
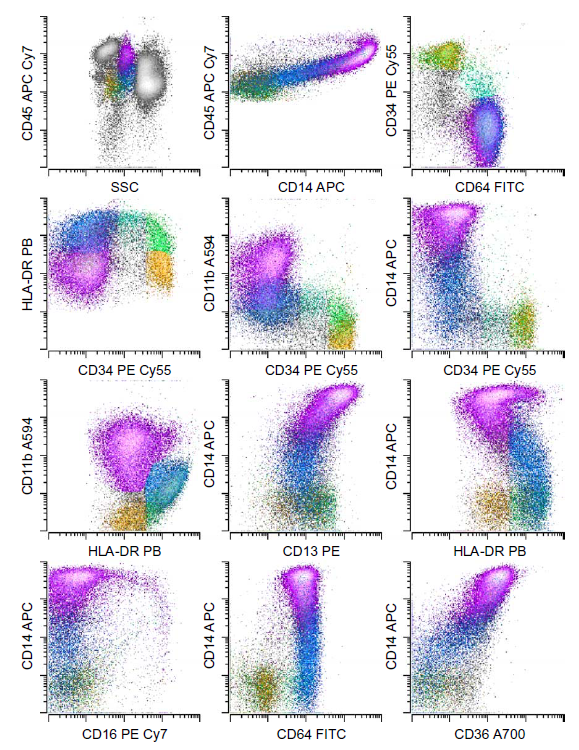
图 7. 正常骨髓单核细胞分化发育模式图:早期祖细胞——原始细胞——幼单细胞 ——单核细胞

图 8. MDS 骨髓样本单核细胞常见的异常表型
04 看红系的抗原表达和数量
MDS 患者红系免疫表型异常可表现为:红系比例增多;CD117+ 红系祖细胞比例增多或减少;CD71/CD235a 图型模式异常;CD71、CD36 平均荧光强度 CV 增大等。

图 9. 正常红系细胞分化发育模式图:早期祖细胞原始——晚期祖细胞——原红细胞——早幼红细胞——中幼红细胞——晚幼红细胞——红细胞
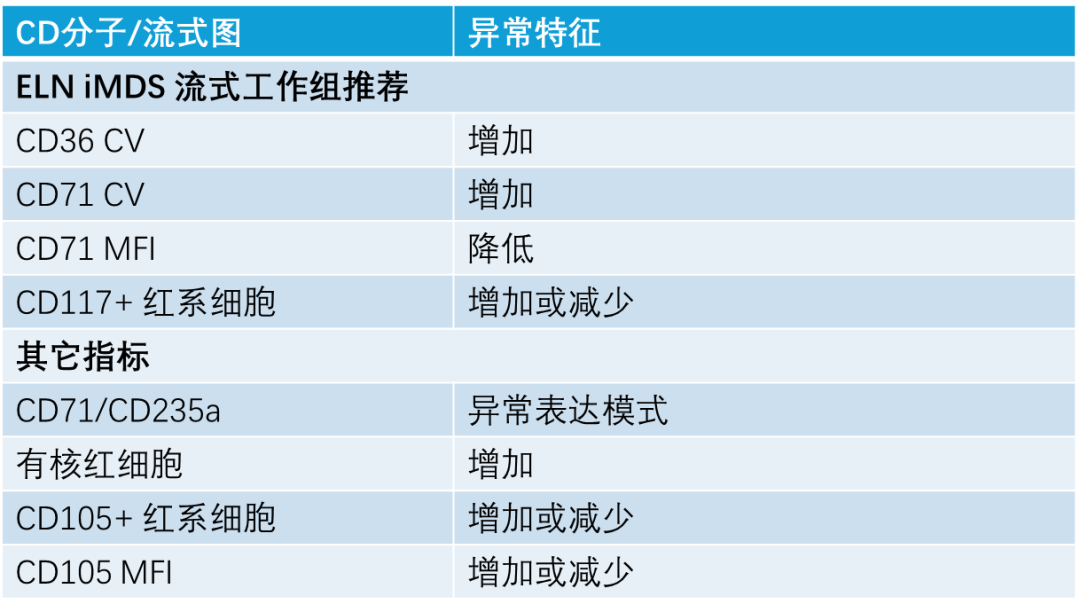
图 10. MDS 骨髓样本红系细胞常见的异常表型
05 MDS 流式细胞术评分系统(MDS FCM Scoring System)
流式细胞分析单一抗原表型的异常在临床上区分正常和发育异常细胞群体特异性有限,因此不能成为单独诊断 MDS 的依据。MDS 流式细胞术评分系统,是指使用不同流式检测方案的检测指标来量化免疫表型和严重程度,可以有效区分 MDS 与正常/反应性细胞群,提高 MDS 的诊断性能。下图总结了目前验证和发表的 MDS 流式评分系统,主要包括 Ogata,RED,ELN-NEC,FCSS,iFS 和 ProGraME 等。
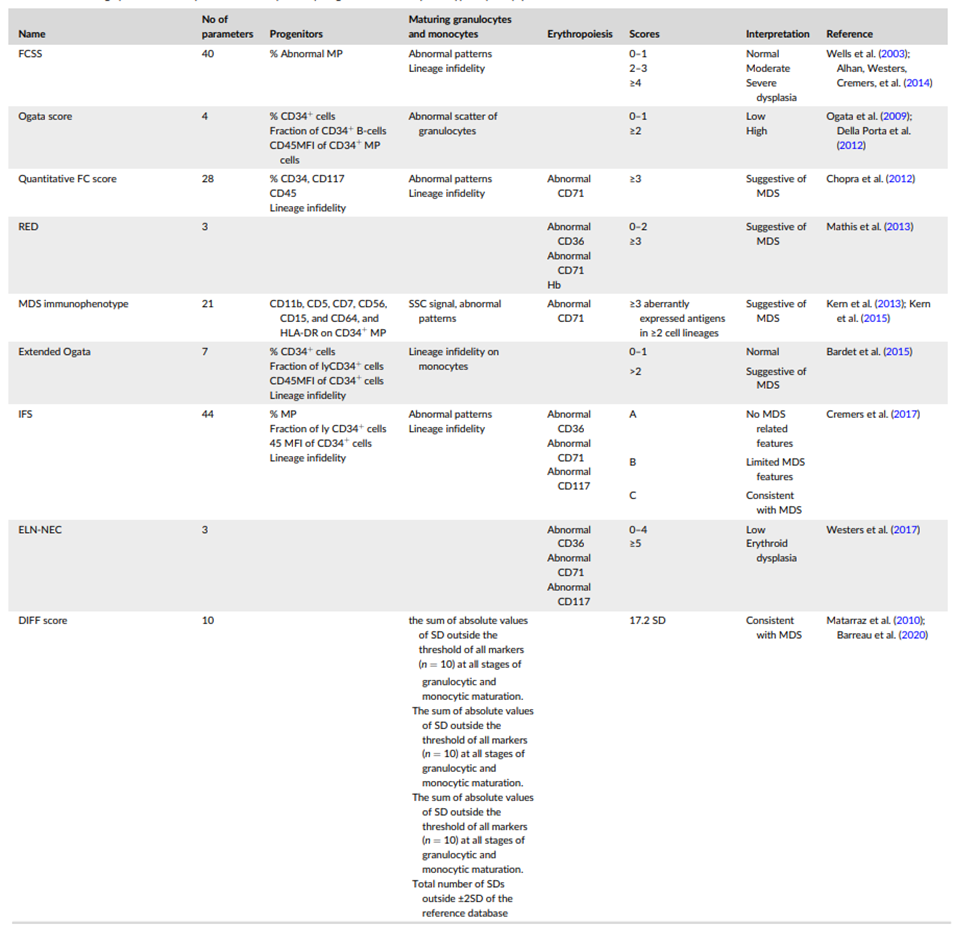
图 11. MDS FCM 流式评分系统
Part 3 MDS 流式检测案例

图 12. MDS 髓系原始细胞的异常免疫表型。
(A) 正常骨髓样本。
(B) MDS 骨髓样本,其中: CD34+ 原始细胞比例 2.4%,包括异常髓系原始细胞 1.6%(CD34 表达强度增加、分布聚集、CD38 表达强度减弱、CD15 弱表达、CD33 表达强度减弱、均匀和 CD4 表达强度轻度增加)。
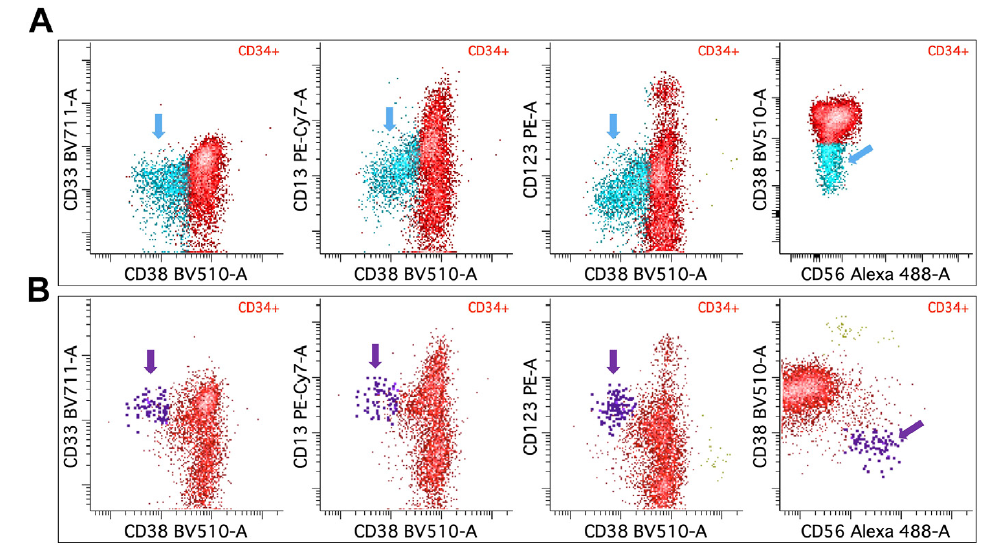
图 13. MDS CD34+ 原始细胞的异常免疫表型
(A) 正常骨髓 CD34+ 原始细胞。
(B) MDS 骨髓异常 CD34+ 原始细胞,其 CD33、CD13、CD123 表达强度升高以及伴 CD56 异常表达。
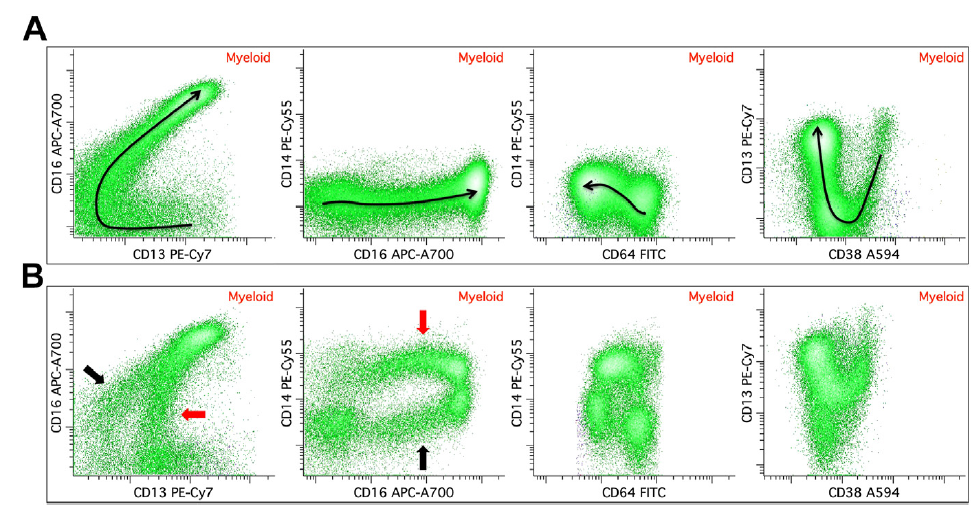
图 14. 成熟的粒细胞发育异常
(A) 正常骨髓粒细胞发育轨迹。
(B) MDS(伴 7 号染色单体异常)异常粒细胞 CD13 和 CD14 表达强度明显增加。
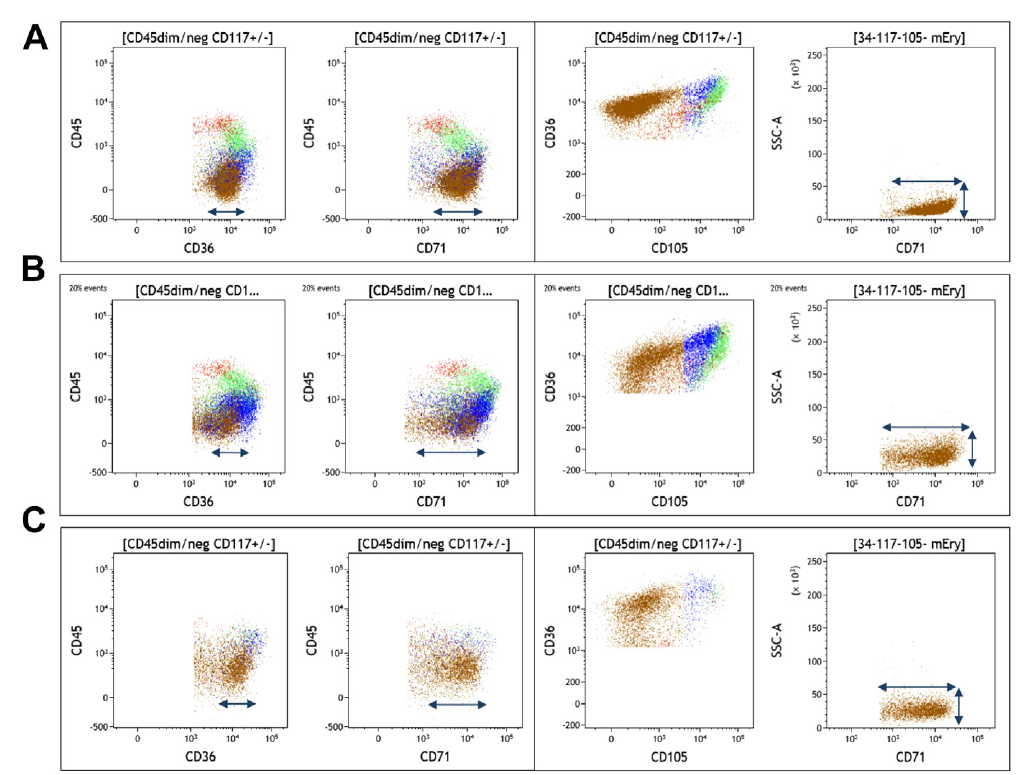
图 15. MDS 中的红细胞成熟异常
(A) 正常红细胞。CD34-/CD117-/CD105- 成熟红细胞:均一表达 CD36,异质表达 CD71,SSC 较低。
(B) MDS 伴 SF3B1 突变。成熟红细胞 CD71 和 CD36 的 CV 增加,SSC 增加。
(C) 低级别 MDS。成熟红细胞 CD71 和 CD36 的 CV 增加,SSC 增加。
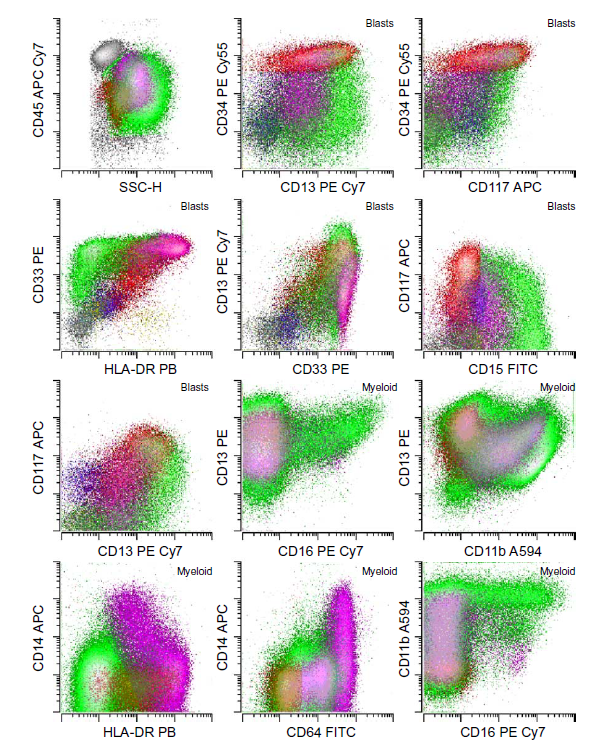
图 16. MDS 中的红细胞成熟异常
MDS 流式检测的临床意义与应用小结
MDS 患者常用危险度分层系统包括国际预后积分系统(IPSS)、WHO 分型预后积分系统(WPSS)和修订的国际预后积分系统(IRSS-R)。MDS 患者原始髓系细胞、粒细胞和单核细胞免疫表型异常与 IPSS、WPSS、AML 转化风险以及治疗结局如造血干细胞移植相关。同时 IWG-PM 小组的研究表明,FCM 评分通常与 MDS 相关的细胞遗传学异常如 7 号单体、del (5q) 和细胞遗传学评分增加相关。人体免疫失调包括髓系炎症反应和适应性免疫反应异常在 MDS 的发病机制中起着重要作用,如 CD4+ 和 CD8+T 细胞、NK 细胞、单核细胞和树突状细胞的数量和功能状态与 MDS 疾病严重程度相关。
因此,FCM 作为一种快速细胞分析和检测平台,可以为 MDS 的早期诊断、预后和病情进展监测提供指标。
Part 4 流式细胞仪及其配套解决方案
可检测样本
骨髓、外周血、淋巴结、细针穿刺、脑脊液、胸腹水、血清、血浆等标本
仪器和试剂
1、具备国际认可的标准化方案或专家共识中推荐的荧光染料标记和克隆号的流式检测抗体;
2、具备智能、多色、高性能的流式细胞仪,可满足稀有样本、多参数同时检测的需求;
3、部分机型支持样本回收功能,剩余的未被检测样本可自动回收至样本管内进行保存或进一步检测,对稀有样本友好;
4、高精度注射泵上样,样本体积精确控制,无需任何耗材直接绝对计数;
5、可选配自动上样器,实现孔板和试管架上批量样本的自动快速采集;
6、提供自动化的仪器 QC 测试功能,并跟踪一段时间的测试结果,确保提供一致的结果;
7、提供自动、手动两种荧光补偿方法,可以方便快速地实现多个荧光通道之间的正确补偿;
8、配套 DNA、淋巴细胞亚群、细胞因子等分析软件;此外采集样本并分析数据后可导出为模板文件,简化后续分析步骤、减少重复工作、提高工作效率。
此文仅供科普,对患者的临床诊治应结合其症状/体征、病史、其它实验室检查及治疗反应等情况综合考虑。
参考资料
1. 刘艳荣. 实用流式细胞术——血液病篇(第2版)[M] 北京: 北京大学医学出版社; 2023.
2. 国家医学检验临床医学研究中心(中国医科大学附属第一医院),中华医学会检验医学分会,国家卫生健康委临床检验中心,等. 流式细胞术的临床应用专家共识[J]. 中华检验医学杂志,2023,46(08):792-801.
3. 中华医学会血液学分会. 骨髓增生异常综合征中国诊断与治疗指南(2019年版)[J]. 中华血液学杂志,2019,40:(2):89-97.
4. Alaggio R, Amador C, et al. The 5th edition of the World Health Organization Classification of Haematolymphoid Tumours: Lymphoid Neoplasms. Leukemia. 2022 Jul;36(7):1720-1748.
5. Wood B. Multicolor immunophenotyping: human immune system hematopoiesis. Methods Cell Biol. 2004;75:559-76. doi: 10.1016/s0091-679x(04)75023-2. PMID: 15603442.
6. Chen X, Johansson U, Cherian S. Flow Cytometric Assessment of Myelodysplastic Syndromes/Neoplasms. Clin Lab Med. 2023 Dec;43(4):521-547. doi: 10.1016/j.cll.2023.06.006. Epub 2023 Aug 7. PMID: 37865501.
7. Porwit A, Béné MC, Duetz C, et al. Multiparameter flow cytometry in the evaluation of myelodysplasia: Analytical issues: Recommendations from the European LeukemiaNet/International Myelodysplastic Syndrome Flow Cytometry Working Group. Cytometry B Clin Cytom. 2023 Jan;104(1):27-50. doi: 10.1002/cyto.b.22108. Epub 2022 Dec 20. PMID: 36537621; PMCID: PMC10107708.
8. van de Loosdrecht AA, Kern W, et al. Clinical application of flow cytometry in patients with unexplained cytopenia and suspected myelodysplastic syndrome: A report of the European LeukemiaNet International MDS-Flow Cytometry Working Group. Cytometry B Clin Cytom. 2023 Jan;104(1):77-86. doi: 10.1002/cyto.b.22044. Epub 2021 Dec 13. Erratum in: Cytometry B Clin Cytom. 2024 May;106(3):216. doi: 10.1002/cyto.b.22141. PMID: 34897979.






