推荐产品
公司新闻/正文
Cell:为 T 细胞输送能量!细胞间线粒体转移增强 T 细胞代谢适应性和抗肿瘤能力
220 人阅读发布时间:2025-03-05 14:05
过继性 T 细胞疗法在治疗血液系统恶性肿瘤方面取得了显著疗效,但在实体瘤治疗中效果有限。一个主要的障碍在于抑制性的肿瘤微环境会破坏 T 细胞的线粒体功能,从而导致 T 细胞耗竭。线粒体功能障碍会引发与终末耗竭相关的转录和表观遗传程序,削弱 T 细胞的抗肿瘤反应,进而促进癌症免疫逃逸。因此,开发能够增强 T 细胞线粒体功能的策略备受关注。
2024 年 9 月 13 日,德国莱布尼茨免疫治疗研究所、美国国立卫生研究院、哈佛大学医学院等机构的研究人员合作,在 Cell 期刊上发表了题为 “Intercellular nanotube-mediated mitochondrial transfer enhances T cell metabolic fitness and antitumor efficacy” 的研究论文,发现骨髓基质细胞可以通过纳米管与 T 细胞建立连接,并将线粒体转移到 CD8+ T 细胞中,从而增强 T 细胞的代谢适应性和抗肿瘤效果。

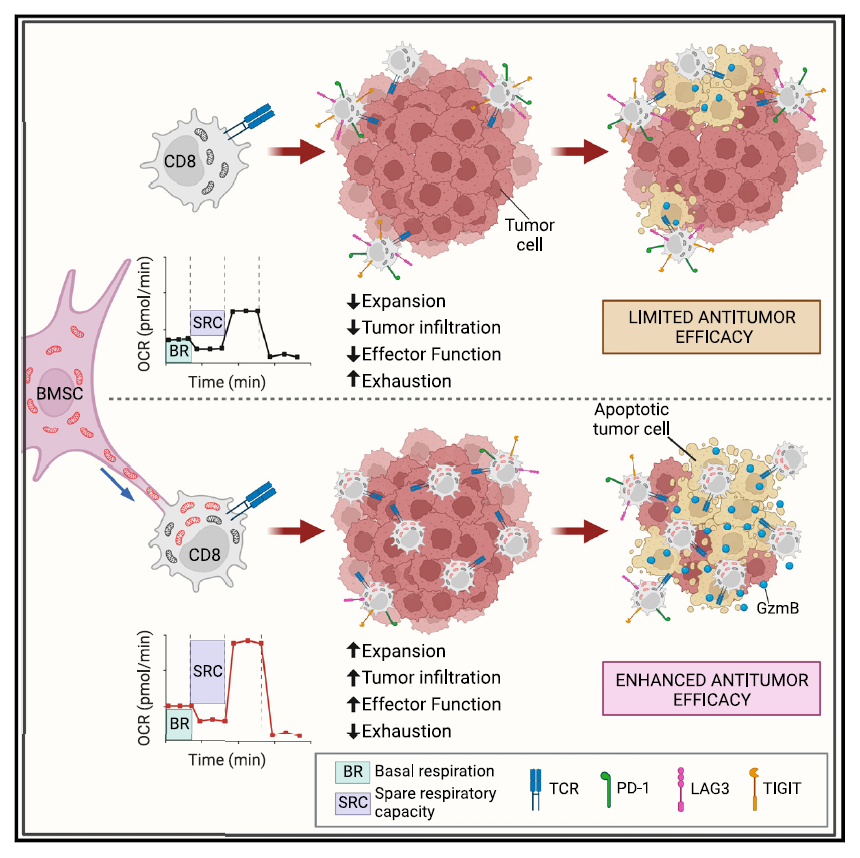
线粒体功能与 CD8+ T 细胞的扩增、持久性和抗肿瘤功能密切相关。因此,增强 T 细胞的线粒体功能被认为是提升癌症免疫疗法效果的关键策略之一。近年来,细胞间线粒体转移现象引起了广泛关注。目前认为,线粒体转移最主要的途径之一是通过隧道纳米管(tunneling nanotubes)介导。为了研究骨髓基质细胞(BMSCs)与 CD8+ T 细胞之间的相互作用,研究人员将人或小鼠的 BMSCs 与相应的 CD8+ T 细胞共培养,观察到 BMSCs 通过纳米管与CD8+ T 细胞相连,并将线粒体转移到 T 细胞中。这种线粒体转移现象在小鼠和人类细胞中均存在,且转移后的线粒体保持了完整的线粒体膜电位,并增加了受体 CD8+ T 细胞的线粒体 DNA 含量。
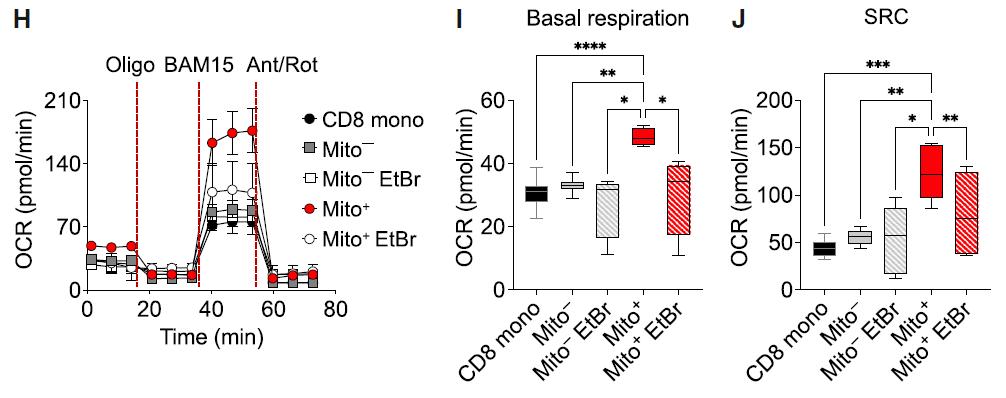
为评估供体线粒体对 CD8+ T 细胞呼吸的影响,研究人员测量了小鼠CD8+ T 细胞的氧消耗速率(OCR)。结果显示,与未获得线粒体的 CD8+ T 细胞(Mito-)或未与 BMSCs 共培养的 CD8+ T 细胞(CD8 mono)相比,获得供体线粒体的 CD8+ T 细胞(Mito+)表现出显著提高的线粒体基础呼吸和备用呼吸能力(SRC)。为了排除 Mito+ 细胞线粒体活性增强是由于细胞间转移了其他细胞质因子的可能性,研究人员用低剂量溴化乙锭(EtBr)预处理 BMSCs ,使供体线粒体部分功能失调。在 Mito+ EtBr 细胞中,线粒体活性的增强被消除。这些结果在功能上验证了线粒体向 CD8+ T 细胞的有效转移,并表明 Mito+ 细胞中增强的代谢活性依赖于供体线粒体。
线粒体转移增强CD8+ T细胞的代谢适应性
研究人员进一步探索了线粒体转移的机制,发现 BMSCs 和 T 细胞之间的线粒体转移依赖于 Talin 2(TLN2) 蛋白。在 CD8+ T 细胞或BMSCs 中敲除 TLN2 均显著抑制线粒体转移率,其中 BMSCs 中的影响更为显著。
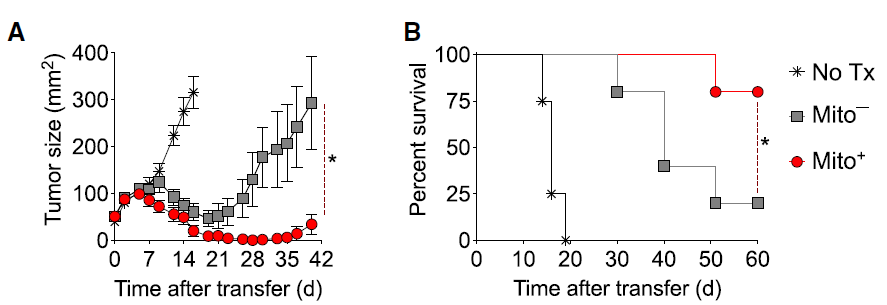
线粒体备用呼吸能力是细胞的能量储备,细胞在应对增加的压力或工作负荷时会利用这一储备。研究人员推测, Mito+ 细胞中观察到的更高备用呼吸能力将为细胞在肿瘤微环境中的生存提供能量优势。结果显示,在黑色素瘤小鼠模型中,与 Mito- 细胞相比, Mito+ 细胞介导了更显著的肿瘤消退,显著延长了小鼠的生存期。
线粒体转移增强CD8+ T细胞的抗肿瘤能力
进一步的实验表明,转移的线粒体赋予了T细胞更强大的扩增能力, Mito+ 细胞能够高效浸润肿瘤。转移的线粒体促进了强大的效应反应,同时赋予了 T 细胞在肿瘤微环境中抵抗终末耗竭的能力。而且,转移的线粒体可以通过多次细胞分裂传递给子代细胞,与 Mito- 细胞相比, Mito+ 细胞在转移后 1 个月仍具有更高的线粒体含量,表明线粒体转移所提供的优势可以在较长时间内持续存在。
此外,线粒体转移也增强了人 CD19-CAR T 细胞和肿瘤浸润淋巴细胞(TILs)的抗肿瘤免疫反应。研究人员在体外评估了 CD19-CAR T 细胞对 NALM6-GL 白血病细胞的细胞毒性,与Mito- 细胞相比,Mito+ 细胞显示出显著增强的肿瘤杀伤能力。为确定线粒体转移是否赋予 CD19-CAR T 细胞抵抗耗竭的能力,研究人员评估了 Mito+ 细胞在反复挑战下对 NALM6-GL 白血病细胞的杀伤能力。Mito+ 细胞在整个六轮刺激中均保持了对癌细胞的强大细胞毒性,而 Mito- 细胞在第三轮开始失去杀伤能力,并在第六轮时几乎完全功能耗竭。在小鼠模型中, Mito+ 细胞的抗肿瘤活性增强,对 NALM6-GL 白血病的控制得到延长,并显著提高了小鼠的存活率。移植健康的线粒体对于 TILs 的应用可能具有特别重要的意义,因为其内源性线粒体常常被肿瘤微环境中的恶劣条件不可逆地破坏。同样的,当用表达靶抗原的黑色素瘤细胞 SK23-GFP 刺激时,与 Mito- TILs相比, Mito+ TILs 介导的肿瘤清除能力增强。
综上所述:
该研究发现细胞间纳米管介导线粒体从骨髓基质细胞向 CD8+ T 细胞转移。获得线粒体的 CD8+ T 细胞显示出增强的线粒体呼吸和备用呼吸能力。当这些“超级充电”的 T 细胞被转移到荷瘤小鼠体内时,能够更强劲地扩增,更高效地浸润肿瘤,并表现出更少的耗竭迹象。因此,线粒体增强的 CD8+ T 细胞能够介导更强的抗肿瘤反应,延长动物的生存期。这些发现为增强 T 细胞的代谢适应性和抗肿瘤功能用于过继性免疫治疗提供了技术基础,为下一代细胞疗法开辟了新的途径。






