推荐产品
公司新闻/正文
用于 3D 模型能量代谢研究的安捷伦 Seahorse XF Flex 分析仪及优化的工作流程
434 人阅读发布时间:2025-08-06 13:13
应用简报
3D 模型中的实时代谢分析易如反掌
探索优化的 Seahorse XF 工作流程,了解在复杂组织模型中成功进行实时代谢分析的窍门与技巧。
摘要
神经元的发育和功能作用是机体内能量需求最高的生物过程之一。大脑需要持续、即时的能量供应以维持正常功能,这依赖于线粒体呼吸和糖酵解的协同作用来持续生成 ATP 以满足需求。有氧代谢紊乱和线粒体功能障碍是多种与认知功能衰退相关的衰老及神经退行性疾病的共同病理特征。不同的大脑区域和结构具有不同的功能及能量需求。为研究大脑中的线粒体代谢,研究人员常采用神经元培养或从脑组织中分离线粒体的方法。但这些方法组织需求量大,而且无法还原真实的复杂组织微环境,也无法捕获脑组织内多种细胞类型间的相互作用。
本应用简报介绍了使用安捷伦 Seahorse XF Flex 分析仪及简化的工作流程,检测并定量评估来自不同大脑区域的小型活检圆形组织样本的能量代谢。我们展示了使用安捷伦 Seahorse XF Flex 3D 捕获微孔板-L 和安捷伦 Seahorse XF 3D 线粒体压力测试试剂盒从脑组织样本中获取的代谢数据。此外,还探讨了用于 Seahorse XF 检测的脑组织样本制备和优化技术以及数据分析方法。
安捷伦 Seahorse XF 平台是一种集成式的无标记解决方案,无缝整合了 Seahorse XF 分析仪、探针板、检测试剂盒和软件,可提供实时功能性代谢数据。该平台提供耗氧率 (OCR) 和细胞外酸化率 (ECAR) 等关键参数,这些参数是线粒体健康状况、毒性、糖酵解和总体细胞功能/功能障碍的重要衡量指标。
1 前言
业界对 3D 细胞模型分析工具和试剂的需求正在快速增长。精密组织切片、器官芯片、生物打印和类器官都是这类 3D 模型的典型代表。其中,精密组织切片尤其受到关注,因为它们易于获取、成本低,且样本中包含各类支持性细胞,能够保留组织的天然微环境。组织样本能够模拟体内环境,并且相比传统的二维培养细胞能够更准确地反映生理学特征,因此广泛应用于研究和药物筛选[1,2,3,4]。
安捷伦 Seahorse XF 分析仪是评估代谢功能的金标准方法,通过测量耗氧率 (OCR) 和细胞外酸化率 (ECAR),可以分别了解线粒体呼吸和糖酵解情况。尽管这项技术为了解代谢如何影响细胞功能及驱动疾病进展提供了重要信息,但其数据主要来源于二维培养细胞或分离的线粒体,无法全面捕获组织的复杂微环境的影响。
为解决这一问题,研究人员开发了使用组织切片(包括脑组织)离体测量线粒体呼吸的方法。这些方法能够真实反映细胞微环境的生理学特征,包括细胞间协同作用及不同细胞类型的代谢偶联。目前,研究人员对大脑生物能量代谢的理解已不再局限于简单的静态过程,而是能够进行代谢重编程与适应性调节的动态模式。这一动态模式涉及线粒体对多种能量底物的利用,以及在糖酵解和氧化磷酸化之间动态调控 ATP 生成方式。研究表明,在衰老和病理状态下,神经胶质细胞在炎症激活时会发生代谢转变[5,6,7,8]。这些研究为脑组织的研究流程提供了重要见解,但它们所使用的多种 Seahorse XF 仪器和消耗品并未针对组织样本进行优化。
本应用简报以脑组织切片为例,介绍了一种用于 3D 模型能量代谢研究的新型 Seahorse XF 系统。该系统包含 Seahorse XF Flex 3D 捕获微孔板-L、Seahorse XF 3D 线粒体压力测试试剂盒、振动组织切片机和 Seahorse XF Flex 分析仪(图 1 )。
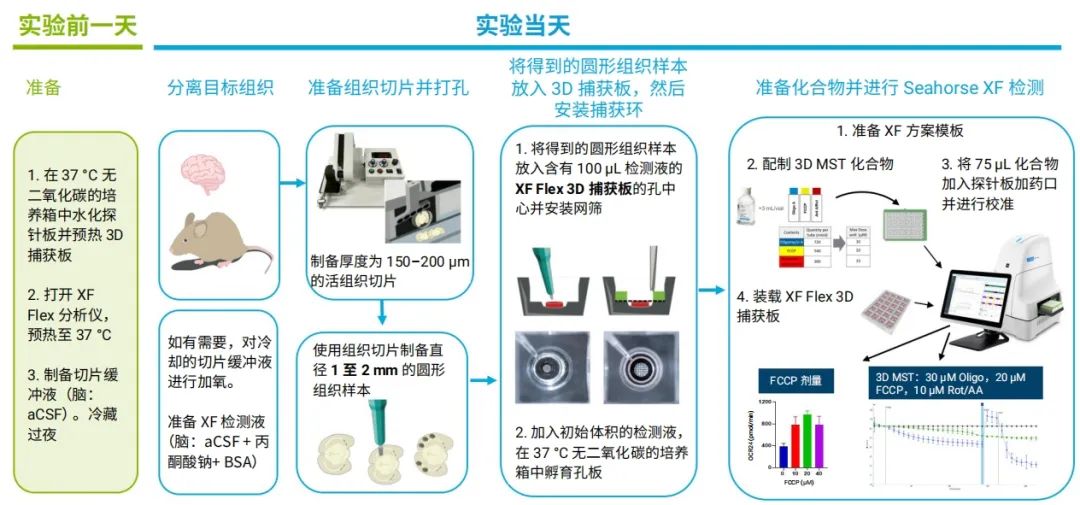
图 1.安捷伦 Seahorse XF Flex 3D 组织工作流程图,给出了实验的关键步骤
Seahorse XF Flex 分析仪采用先进的实验设计和数据分析功能,显著提升了灵敏度和精密度。3D 捕获板-L 是一块 24 孔板,每个孔的底部都有一个样品室,深 250 μm,直径 3.15 mm,可用于分析相同尺寸或更小尺寸的组织切片。此外,每个孔还配有一个捕获环,用于将组织固定到位,并在测量时形成一个 8.5 μL 的瞬态微室。捕获环上的网筛孔径较大,可确保 Seahorse XF 检测期间气体和各种化学物质能够充分进入,并有利于恢复检测液条件。Seahorse XF 3D 线粒体压力测试试剂盒包含电子传递链调节剂,可用于需要高剂量的研究模型,例如组织样本和小型生物体。该系统提高了检测灵敏度、结果重现性和操作便利性。
2 实验部分
组织前处理和 Seahorse XF Flex 3D 捕获微孔板-L 的操作
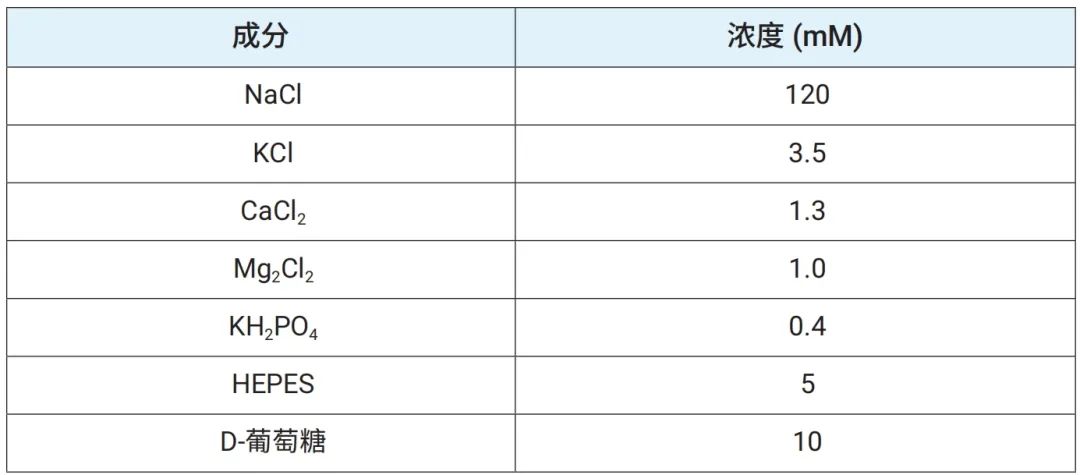
从 Taconic Biosciences (SD-F,MPF 级)购得九周龄雌性 Sprague Dawley 大鼠,在 Hooke Laboratories 适应数日后,于 Seahorse XF 实验当天早上进行大鼠脑组织解剖。解剖完成后,立即将获得的大鼠脑组织放入已预冷且加氧的人工脑脊液 (aCSF) 缓冲液中(表 1),送至位于美国马萨诸塞州列克星敦市的安捷伦实验室,并在该实验室准备组织用于 Seahorse XF 实验。
表 1.人工脑脊液成分。将缓冲液 pH 值调整为 7.4 并储存在 4℃ 下。使用前通氧 1 小时
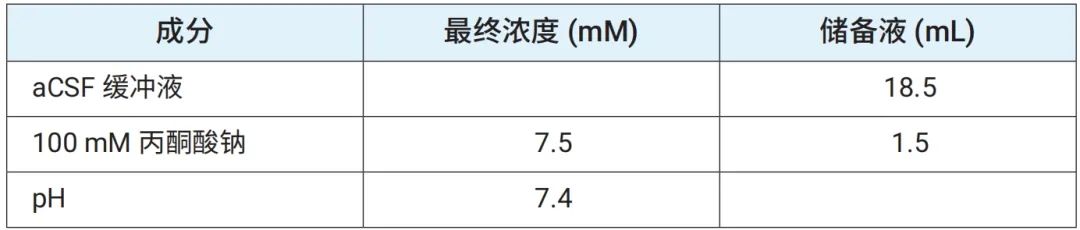
在处理组织之前,将 100 mL 添加了 0.6 mM 丙酮酸钠的 Seahorse XF aCSF、100 mL 添加了 0.6 mM 丙酮酸钠和 0.4% 不含脂肪酸的 BSA 的 aCSF,以及 20 mL 添加了 7.5 mM 丙酮酸钠、pH 为 7.4 的 aCSF (分别参见表 2A、2B 和 2C)预热。在 37℃ 下将 pH 值调节至 7.4,并在使用前进行过滤灭菌。将表 2A 中的缓冲液取 100 μL 添加到 3D 捕获板-L 的每个孔中,放置一旁,直到准备好圆形组织样本。
表 2A.含 0.6 mM 丙酮酸钠的安捷伦 Seahorse XF aCSF 检测液(无 BSA)
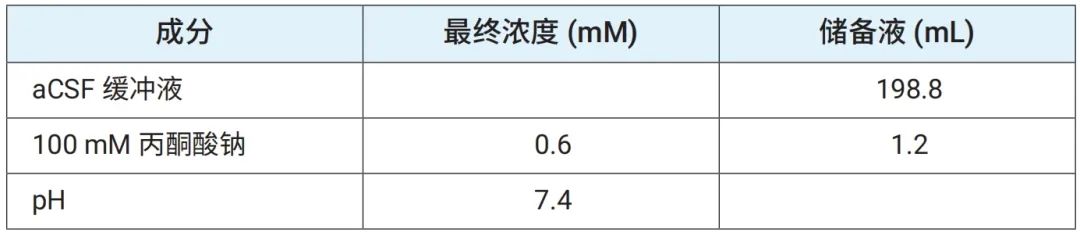
表 2B.含 0.6 mM 丙酮酸钠和 0.4% BSA 的安捷伦 Seahorse XF aCSF 检测液
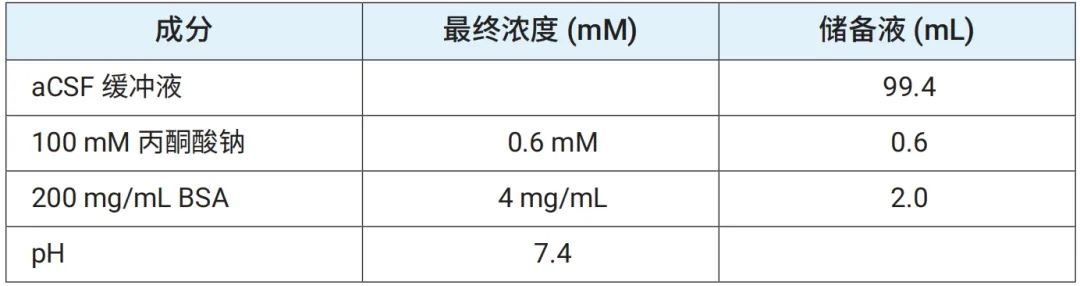
表 2C.含 7.5 mM 丙酮酸钠的安捷伦 Seahorse XF aCSF 检测液(无 BSA)
脑组织送至实验室后,按照制造商的建议,使用 Compresstome VF-510-0Z 振动切片机 (Precisionary Instruments,LLC) 在冷却且加氧的 aCSF 缓冲液中制作脑组织切片(关键步骤另见图 2)。制作大脑切片时,Compresstome 设置为 Speed 2(速度 2)、Oscillation 4 (振荡 4)。将组织切片转移到含有加氧 aCSF 缓冲液的 6 孔板或培养皿中,每个孔或培养皿的底部放置有打孔垫(TedPella;货号 15087-1)。然后使用所需尺寸的活检打孔工具(TedPella;货号 15110-10、15110-15 或 15110-20)制作圆形组织样本,然后将这些样本置于每孔含有 100 μL 缓冲液的 3D 捕获板-L 内。

图 2.使用 Precisionary Instruments,LLC 的 Compresstome 制备大鼠脑组织切片的关键步骤说明
A1 孔和 D6 孔为背景孔,未放入任何组织。圆形组织样本置于每个孔的中心。然后,在每个孔(包括背景孔)中放置一个 3D 捕获环,网状面朝下,并用力推至孔底。向每个孔中加表 2B 的缓冲液(含 BSA)至总体积为 600 μL。确保孔中没有气泡。然后将装有组织样本的 3D 捕获板-L 放入 37℃ 无 CO2 培养箱中,培养 45-60 分钟,然后进行检测。
Seahorse XF 3D 线粒体压力测试
Seahorse XF 检测按照《安捷伦 Seahorse XF 3D 线粒体压力测试试剂盒用户指南》中的说明进行,包括化合物、试剂和探针板的准备过程。使用表 2A 中的 Seahorse XF 缓冲液配制寡霉素 A 和鱼藤酮/抗霉/素A加药溶液,使用表 2C 中的 Seahorse XF 缓冲液配制 FCCP 加药溶液。使用安捷伦 Seahorse Wave 控制器软件中提供的 Seahorse XF 3D 线粒体压力测试模板,并根据需要进行调整。该模板针对组织样本进行了优化,默认设置为每个循环混合 3 分钟,等待 0 分钟,测量 3 分钟。循环次数设置为基础 3 次、寡霉素 A 15 次、FCCP 3 次、鱼藤酮/抗/霉素 A8 次(图 3)。
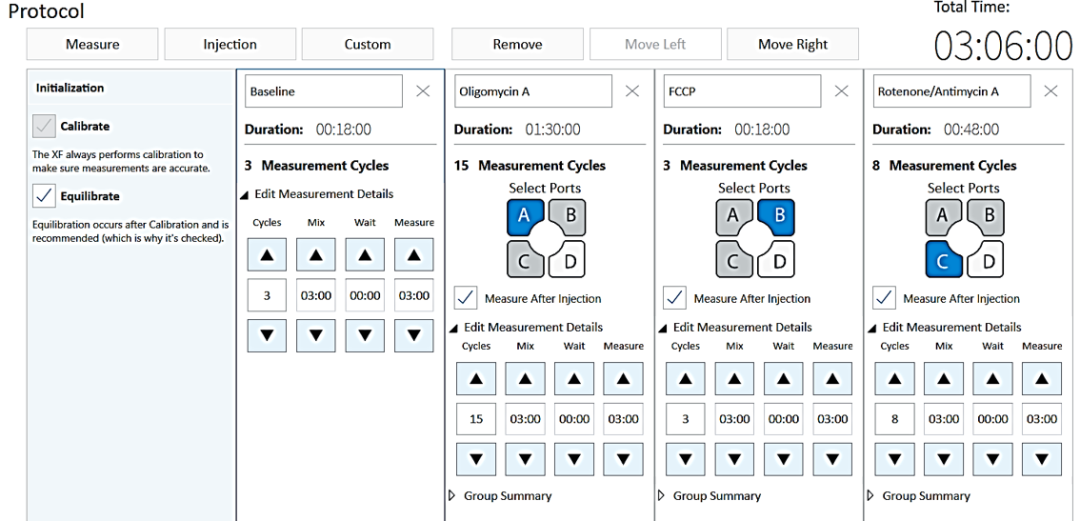
图 3.安捷伦 Seahorse XF Flex 控制器软件中的安捷伦 Seahorse XF 3D 线粒体压力测试模板
蛋白质定量
在 Seahorse XF 检测结束时,去除 3D 捕获板-L每个孔中的检测液,然后用 PBS 清洗孔三次以去除 aCSF 缓冲液中的 BSA。背景孔也进行了清洗,然后用作蛋白检测的背景对照。第三次清洗后,将含有蛋白酶抑制剂 (Thermo Scientific) 的 100 μL RIPA 裂解缓冲液 (Thermo Scientific) 直接添加到各孔底部。然后用封口膜密封孔板,置于 -80℃ 下冷冻过夜。将孔板解冻,用移液器反复吸打 RIPA 缓冲液透过网筛,直至组织裂解,从而使组织切片均质化。接下来,以 250g 离心孔板 10 分钟,然后取 25 μL 裂解液转移到 96 孔检测板中(一式两份)。使用电子移液器小心完成此操作,确保移液器内保留微量残液,避免向 96 孔检测板中引入空气或气泡。制作 BSA 标准曲线样品,并将 25 μL 各标准品与背景对照一起添加到检测板中。
使用 Pierce BCA 检测试剂盒 (ThermoScientific),按照制造商的说明测定总蛋白含量。简而言之,将 200 μL 准备好的检测试剂添加到每个孔中,用孔板密封膜密封孔板,然后在微孔板振荡器上混合 0.5-1 分钟。在 37 ℃ 下孵育孔板 30 分钟,然后使用 Agilent BioTek Synergy H1 多功能微孔板检测仪读取 562 nm 下的吸光度。通过标准曲线测定每个未知样品的总蛋白含量,并以此来归一化 Seahorse XF 检测数据。
组织表面积的测定
在安装捕获环之前,使用 Agilent BioTek Cytation 1 细胞成像多功能微孔板检测系统采集 3D 捕获板-L 中组织的高对比度明场图像。使用 Gen5 软件确定每个组织切片的平均直径或面积(见图 4)。
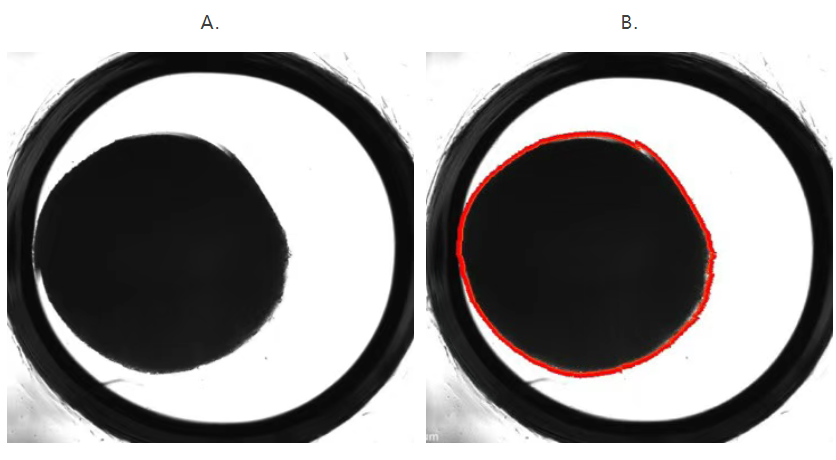
图 4.采用面积测定方法获得的孔图像。内部黑色区域表示组织样本所在位置。(A.) 使用 Agilent BioTek Gen5 软件中的测量工具在 X 轴和 Y 轴方向测定组织样本的直径。(B.) Gen5 面积测量(以红线标识)可自动确定样本直径和面积,但前提是组织样本位于孔中心并且不受样品室(外面的黑色环)边缘的影响
XF 3D 线粒体压力测试数据分析
使用网页版软件平台 Seahorse Analytics 对 Seahorse XF 3D 线粒体压力测试结果文件进行分析和数据转换。利用动力学 OCR 测量,Seahorse Analytics 中的专用功能(小组件)自动计算关键的 3D 线粒体压力测试参数。
材料和设备
3 结果与讨论
检测条件优化
为了有效利用安捷伦 Seahorse XF 分析仪研究代谢和生物能量功能,首先必须确定 Seahorse XF 检测所需的组织用量以及所有调节剂的最佳浓度。
3D 捕获板-L 每个孔底部都有一个深 250 μm、直径 3.15 mm 的样品室。因此,组织切片样本的厚度不应超过 250 μm,直径不应超过 3 mm。建议放入组织后样品室内仍留有一定空间,以便组织与检测液之间能够进行充分的气体和营养交换。
在检测条件优化过程中,使用 Seahorse XF 3D 线粒体压力测试试剂盒测试了直径为 1、1.5 和 2 mm、厚度为 200 μm 的圆形脑组织切片。如图 5 所示,圆形组织样本的尺寸与 OCR 值呈线性关系,表明在该尺寸范围内的样本都是合适或可接受的。
为确定最佳尺寸,需通过完整的线粒体压力测试 (MST) 检测氧和质子浓度数据,以确保覆盖检测中信号的整个动态范围。一般来说,起始基础氧浓度应在 152 mmHg 左右,不得低于 100 mmHg。此外,在每次测量开始时,氧浓度必须完全恢复,并且在每次测量结束时,氧浓度不得低于 40 mmHg。这是因为长时间暴露于极低氧浓度的环境(缺氧)可能对组织健康产生不利影响。此外,pH 值应在探针的线性范围内,即 pH7.5 (+/-0.1) 至 6.5 (+/-0.1) 之间。超出此范围可能导致测量不准确。
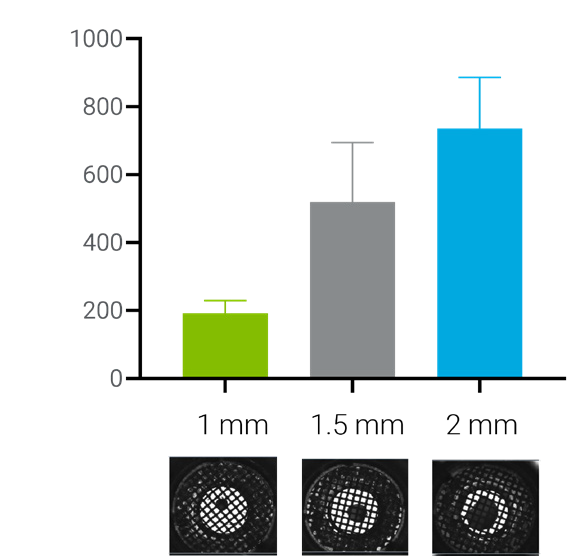
图 5.OCR 信号与圆形组织样本的尺寸相关。柱状图下方的图像是使用 Agilent BioTek Cytation 1 细胞成像多功能微孔板检测系统拍摄的孔中捕获环下方的圆形组织切片
对于 Seahorse XF Flex 分析仪,针对 3D 捕获板-L 优化了仪器方案中的混合高度和速度,使检测液条件能够在每次测量开始时完全恢复到初始状态。图 6 为可接受数据的示例,检测开始时氧浓度约为 130 mmHg,且每次测量开始时氧浓度均能完全恢复(图 6A)。pH 也处于 7.5 (+/-0.1) 至 6.5 (+/-0.1) 范围内(图 6B)。
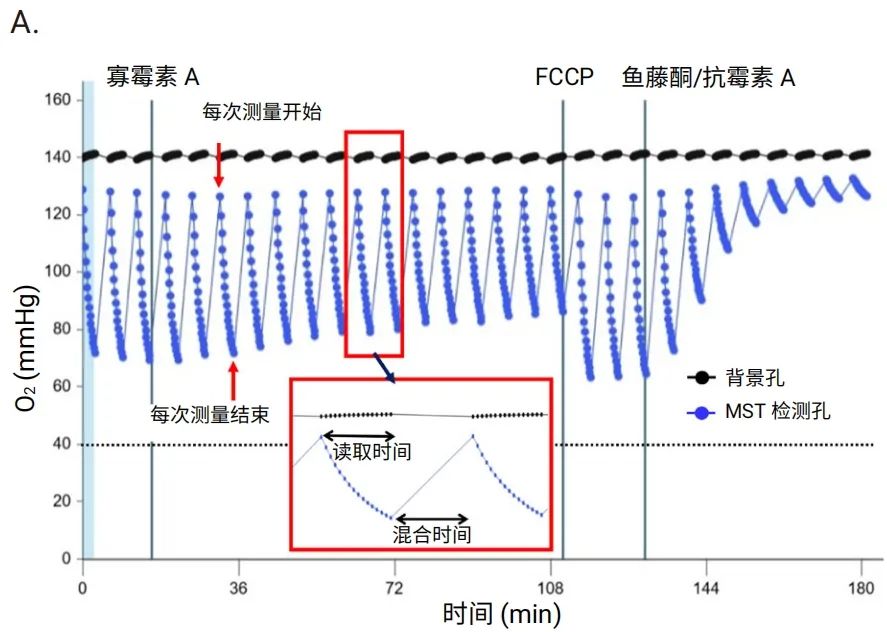
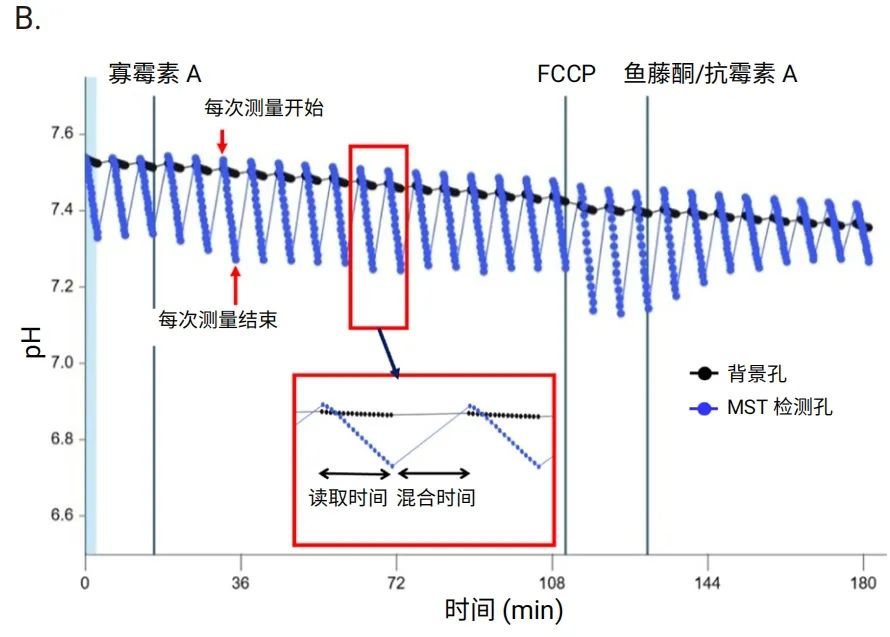
图 6.合适的耗氧 (A) 和 pH (B) 水平
要获得可靠的结果,不同类型组织的最佳调节剂浓度是不同的,因此,在每种组织的检测条件优化过程中应针对每种调节剂进行滴定实验。这对 FCCP 来说尤为重要,因为 FCCP 浓度过低或过高都会导致响应下降,从而低估最大呼吸能力。缓冲液条件也会影响最佳调节剂浓度,例如在检测液中加入 BSA 或血清。因此,当检测液条件改变时也需要进行优化实验。对于呼吸作用较强的组织类型,可以在 FCCP 加药缓冲液中添加更高浓度的底物,例如丙酮酸钠和葡萄糖,以尽可能减少检测过程中的底物耗竭情况。
图 7 展示了使用 Seahorse XF 3D 线粒体压力测试试剂盒和大鼠皮层圆形组织切片(厚度为 200 μm、直径为 2 mm)进行的 FCCP 浓度优化实验。在本测试中,所有样本在三次基线测量后均加入了最终浓度为 30 μM 的寡霉素 A。加入寡霉素 A 后进行 20 次测量,然后加入不同浓度的 FCCP。检测缓冲液含有约 0.32% BSA。数据显示,不同浓度的 FCCP 都会导致呼吸作用增强,其中 20 μM 时 OCR 最高。因此,确定 FCCP 的最佳浓度为 20 μM。
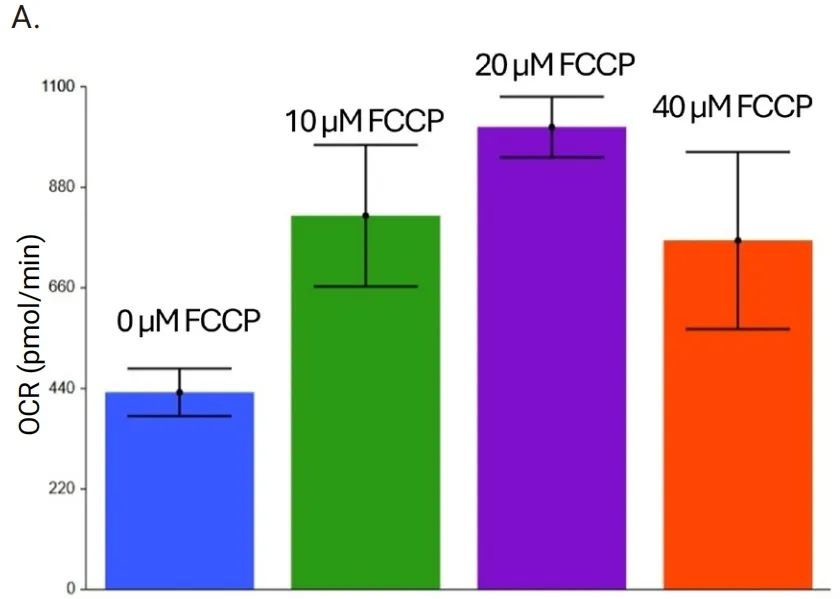
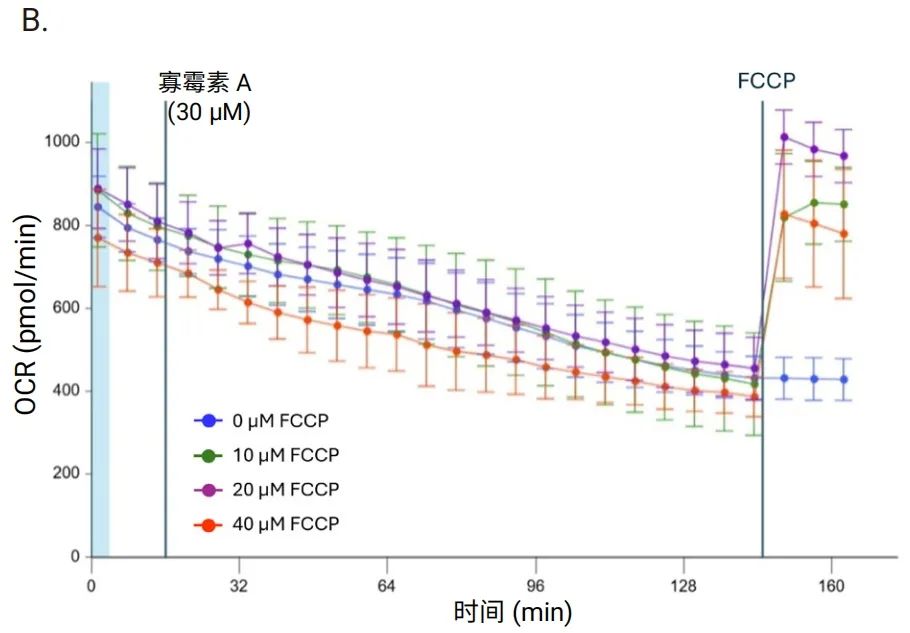
本研究还进行了寡霉素 A 和鱼藤酮/抗/霉素 A 的优化实验(数据未展示),根据实验结果,寡霉素 A 和鱼藤酮/抗/霉素A的最佳浓度分别为 30 μM 和 10 μM。
系统性能评估
图 8 显示了使用由 3D 捕获板-L、3D MST 试剂盒以及 Seahorse XF Flex 分析仪组成的新系统,按照上一节所述优化条件对大鼠脑组织进行线粒体压力测试的结果。如图所示,基础 OCR 非常稳定,所有调节剂均表现出良好的响应动力学(图 8A)。此外,还获得了指示线粒体功能的所有关键参数(图 8B)。
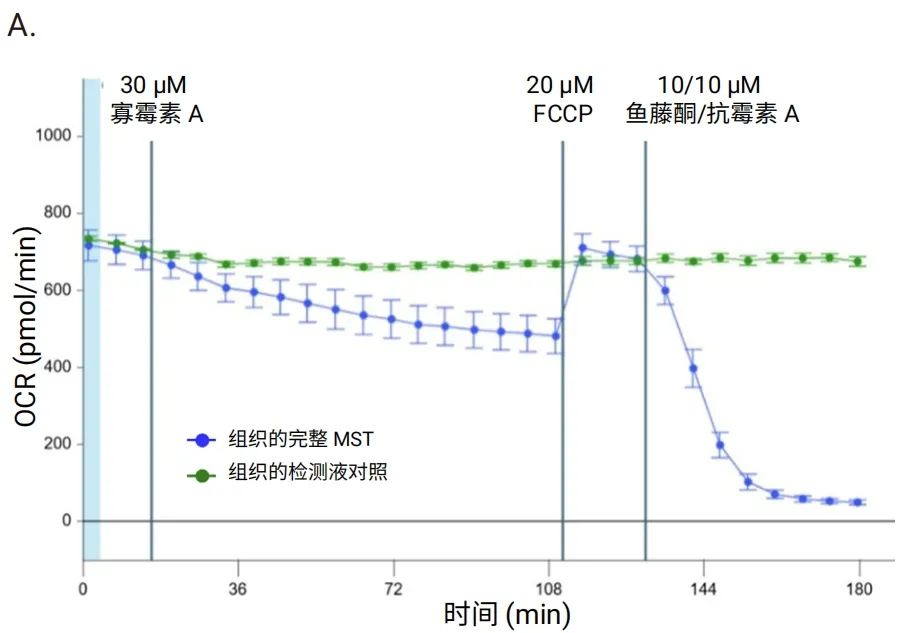
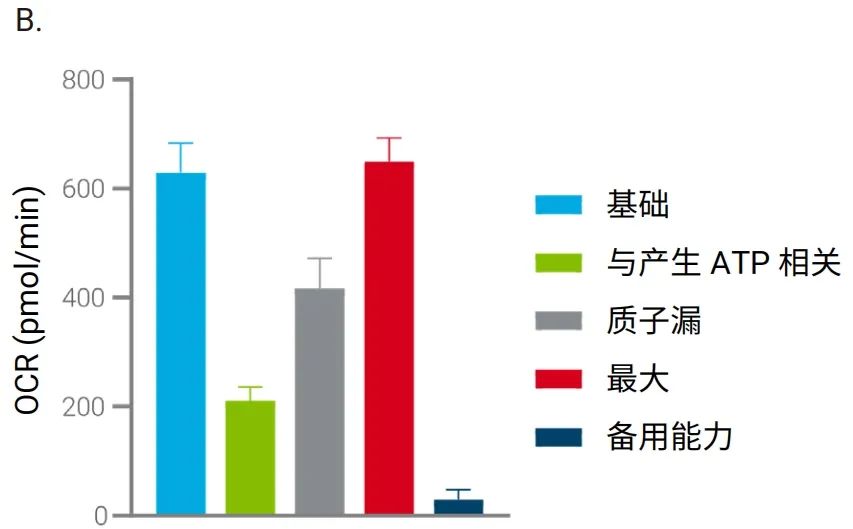
图 8.在 XF Flex 分析仪上使用 3D 捕获板对大鼠脑组织圆形切片 (200 μm x2 mm) 进行安捷伦 Seahorse XF 线粒体压力测试。A. OCR 动力学曲线。B. 线粒体功能的关键参数。n=12 个 MST 孔。n=3 个组织对照孔
相比之下,在 Seahorse XFe24 分析仪上使用 Seahorse XF 胰岛捕获微孔板进行相同的实验,结果显示对调节剂的响应非常小或没有反应(图 9)。这种并列比较清楚证明,由 3D 捕获板-L 和 Seahorse XF Flex 分析仪组成的新系统具有更高的灵敏度和数据稳定性。实验数据还表明,对寡霉素 A 的响应速度远低于在二维培养细胞中观察到的典型响应速度,因此建议在加入寡霉素 A 后进行至少 10 次测量。此外,还建议为每次检测增加组织对照(不添加调节剂),以便在检测条件优化期间监测整个检测过程中呼吸信号的稳定性。
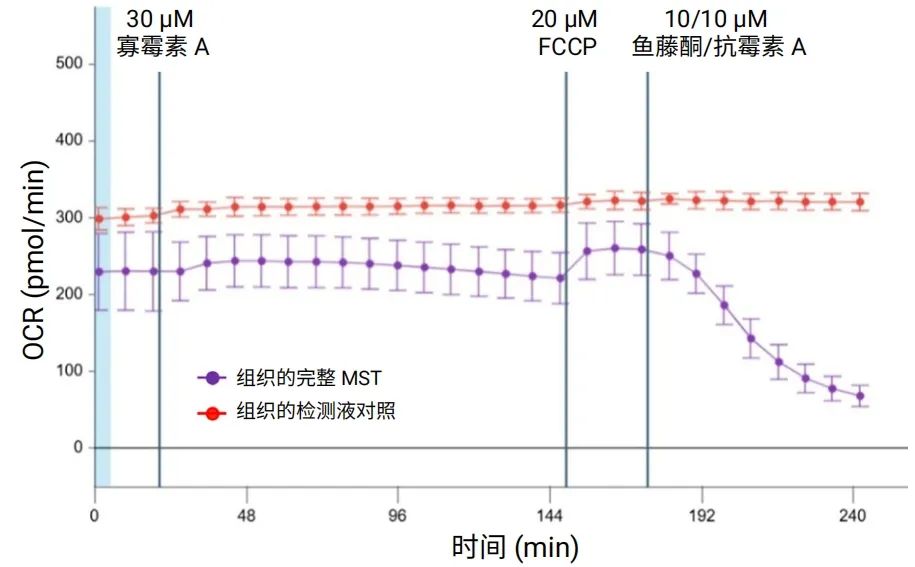
图 9.在安捷伦 Seahorse XFe24 分析仪上使用安捷伦 Seahorse XF 胰岛捕获板对大鼠脑组织圆形切片 (200 μmx2 mm) 进行安捷伦 Seahorse XF 线粒体压力测试的 OCR 动力学曲线。n=12 个 MST 孔。n=3 个组织对照孔
组织前处理注意事项
要成功进行 Seahorse XF 实时代谢分析,必须使用能在数小时内保持健康和活力的组织材料,确保其能在整个检测过程中发挥正常功能。虽然不同类型组织的样品前处理条件可能有所不同,但低温是一个常用条件。例如,大脑和肝脏组织通常需分别在冰冷的 aCSF 或 Krebs-Henseleit 缓冲液 (KHB) 中处理,并且这些缓冲液用 100% 氧气或 95% 氧气: 5% 二氧化碳进行了加氧处理。这些条件可有效降低切片操作对组织造成损伤的风险。另一方面,脂肪组织则可以在室温下制备。但无论何种类型的组织,均需在解剖后尽快完成切片制备。对于其他检测类型的样本处理,建议咨询具有相关组织处理经验的专家。
尺寸均一的组织样本对于获得稳定可靠的检测结果也很重要。文献中报道了多种用于制备小组织样本的方法,例如使用手术剪、活检打孔工具以及各种类型的组织切割器,但我们建议使用振动组织切片机(例如 Precisionary Instruments LLC 的 Compresstome VF-510-0Z)结合活检打孔工具。该方法可以快速制备大量尺寸精确的组织样本,同时大幅减少细胞损伤。Compresstome VF-510-0Z 操作简单,可在 150 至 200 μm 范围内精确控制活组织切片厚度,该范围正是执行 Seahorse XF 检测的推荐厚度范围。研究发现,对于某些组织类型(例如脑组织),在使用打孔工具将组织制备成圆形组织切片之前,将组织切片置于含氧缓冲液中在室温下静置或适应一定时间,有助于确保数据的稳定性。
将组织切片后,使用活检打孔工具制备尺寸均一的组织样本或圆形切片。可以选择目标组织区域的圆形组织切片来研究代谢的空间差异。最好使用带有内置推杆的活检打孔工具,以便轻松地将样本转移到 3D 捕获板-L 内样品室的中心。在打孔制备圆形切片时,建议在组织切片下方放置一个软垫,以实现理想的切割效果并将圆形组织切片压进推杆,以便将其轻松转移并放置到 3D 捕获板-L 内的样品室中。此外,普通软毛画笔可用于辅助处理精密组织切片及圆形切片,软毛可防止转移过程中组织切片受损。
3D 捕获板-L 的工作体积范围为每孔 600 至1000 μL。不过,我们建议在放入组织样本之前,先在每个孔中加入 50 至 100 μL 初始体积的检测液。这些少量的检测液有助于组织样本保持在孔中心,并有利于安装 3D 捕获环。安装捕获环后,建议使用明场成像系统 (4x) 捕获孔内的组织样本图像,以检查是否有气泡。网筛下的气泡可能会导致 0₂和 pH 信号异常,从而导致速率数据波动较大。在进行 Seahorse XF 检测之前应消除气泡。这些图像还有助于检查组织的放置情况,确保所有孔都已按预期放入组织样本。图 10 是已放入组织并安装捕获环的 3D 捕获板-L 的明场图像,可以看出,除了 A3 孔之外,其他孔内圆形组织切片的放置位置是合适的。
A3 孔内的圆形组织切片有一半被卡在环下。检查 OCR 信号发现,该孔的 OCR 值小于孔板平均值的 50%。

图 10.安捷伦 Seahorse XF Flex 3D 捕获微孔板-L 的明场图像。安装 3D 捕获环后,厚度 200 μm 的 2 mm 大鼠大脑皮层圆形组织切片的 4xBFHC 蒙太奇图像
数据分析和归一化选项
Seahorse XF 代谢分析数据可以使用安捷伦云端软件应用程序 Seahorse Analytics 进行分析。该软件具有直观的界面,提供类似桌面软件的交互体验,并且支持全球用户随时随地访问。提供了 3D 线粒体压力测试试剂盒配套分析视图,其中包含专为 3D 模型实验而设计的分析小组件。该分析视图提供了不涉及寡霉素加药的数据分析选项。
Seahorse XF 代谢分析数据的归一化对于检测结果的解读非常重要。对于 3D 样本,可考虑的归一化方案包括:总蛋白、样本大小/重量,以及基线信号百分比(基线校正)。不过,最佳方法取决于所研究的 3D 模型、研究目标以及检测条件(例如检测液成分)。
总蛋白定量是一种较为方便的方法,因为检测板中的组织在完成 Seahorse XF 代谢分析之后,可在裂解缓冲液中于 -80℃ 保存数日。确保充分裂解组织样本非常重要。如果检测液中含有 BSA 或血清,则需要进行清洗步骤。图 11 比较了用总蛋白进行归一化的数据和未归一化的数据。如图所示,蓝色实验组中两个样本在整个检测过程中表现出 OCR 值降低。
使用总蛋白进行数据归一化后,OCR 值调整至与同组中其他样本相近的水平。请注意,该方法不仅测定细胞内蛋白含量,还会受到组织样本中细胞外基质蛋白含量的影响。
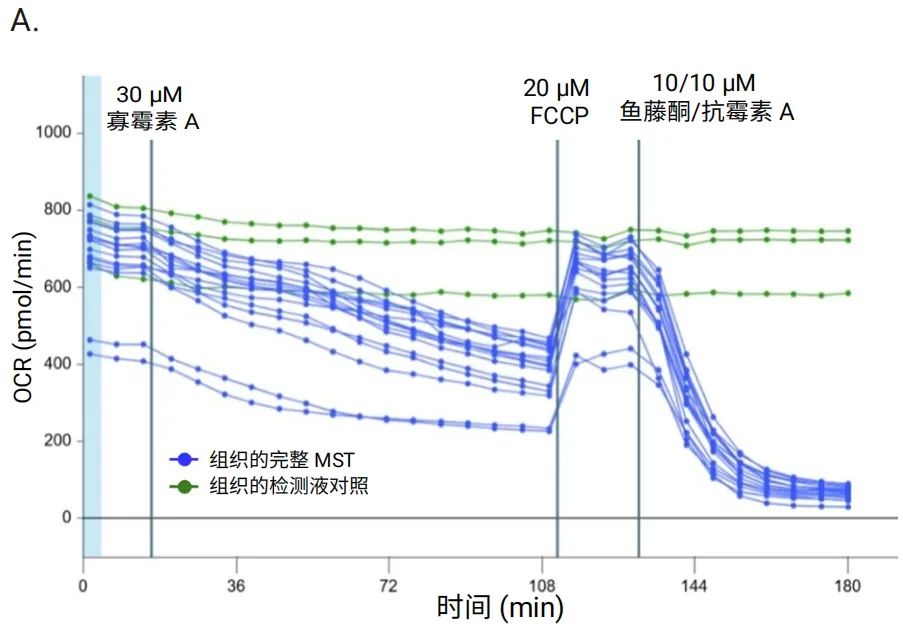
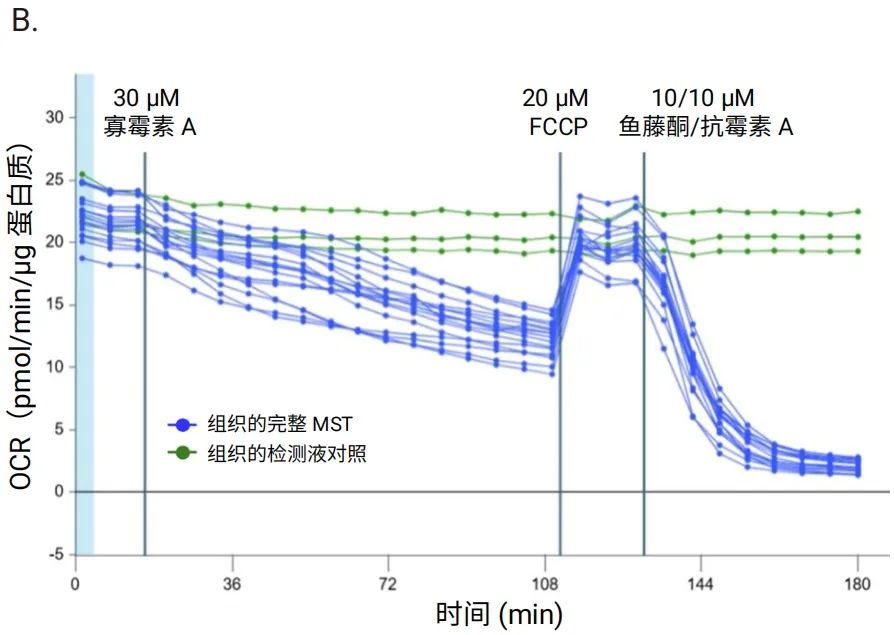
图 11.在安捷伦 Seahorse XF Flex 分析仪上使用 3D 捕获板-L 对大鼠脑组织圆形切片 (200 μmx2 mm) 进行安捷伦 Seahorse XF 线粒体压力测试的 OCR 动力学曲线。每条曲线代表一个孔。A.未归一化的数据。B.基于每孔总蛋白进行归一化后的数据
使用自动成像系统,也可以轻松按样本大小/面积或重量进行归一化。当无法获得一致的组织样本时,通常使用此方法。图 12 为基于组织表面积进行归一化的数据示例,所用的数据为图 5 的数据,图 5 显示在 1、1.5 和 2 mm 尺寸中 OCR 值范围为 190 至 730 pmol/min。进行归一化处理后,不同尺寸组织样本的单位面积 OCR 值差异在 30% 以内。
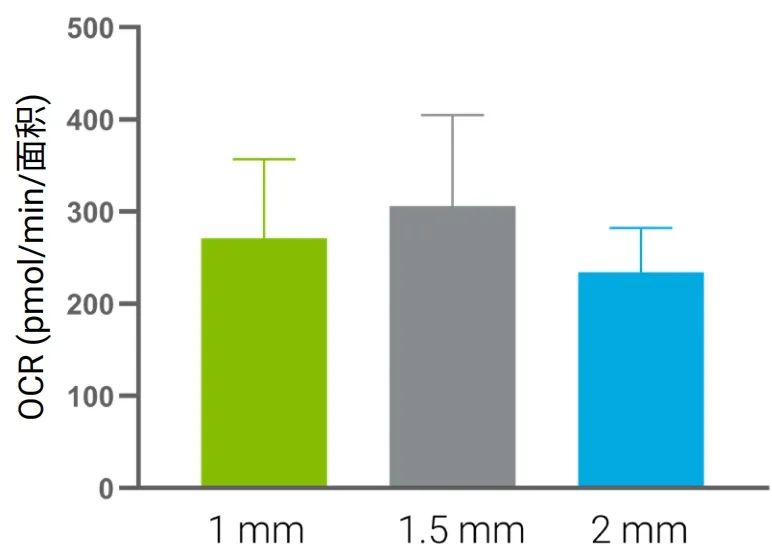
图 12.使用图 5 中未归一化的原始数据,基于样本面积对 OCR 信号进行归一化处理
在某些情况下,Seahorse XF 检测数据也可通过基线信号或动力学曲线中的任意测量值进行归一化。因此,所有其他测量值都表示为相对于基线信号的百分比。这种方法适用于需要比较样本对调节剂急性处理的响应差异的场景,尤其当同一实验组内多个重复样本之间组织材料存在差异时,此方法尤为适用。
图 13 展示了使用图 8A 的相同原始数据经基线校正后的 OCR 动力学曲线。如图所示,与图 8A 相比,所有数据点的误差线更小,并且数据质量较原始未经基线校正的数据显著提升。此方法可以使用 Seahorse Analytics 或 Wave 软件中的 “Baseline” (基线)按钮轻松执行。
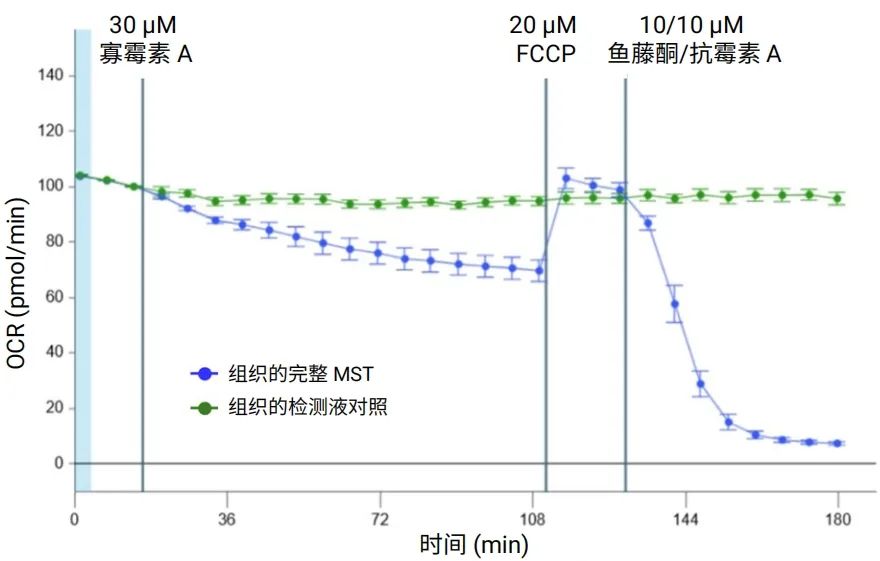
图 13. 图 8A 中的数据经基线校正后的 OCR 动力学曲线
结论
安捷伦 Seahorse XF 技术支持实时代谢分析,彻底改变了活细胞生物能量代谢测量。这项技术为揭示代谢如何驱动疾病进展奠定了基础,有助于推动治疗药物的开发。
Seahorse XF Flex 分析仪搭配专用 3D 捕获板-L,将这一革命性系统的应用范围从传统二维培养细胞扩展到了更具生理相关性的三维模型(例如组织样本),可帮助研究人员获得更多更有用的信息。脑组织分析的结果证明,该系统可提供所需的灵敏度,能够获得稳定的组织呼吸信号,清晰捕捉组织样本对线粒体调节剂的响应,是组织实时代谢分析的理想工具。根据本应用简报中提供的相关指导,研究人员可以更轻松地开展脑组织代谢研究,并大幅提高实验成功率。这套系统及高效工作流程经简单调整后还可以用于其他组织类型和生物体,大大拓展了其在生物医学研究领域的应用范围。
更多详细内容
扫码下载该应用方案查看

参考文献
1. Schwarz, N.; Uysal, B.; Welzer, M.; Bahr, J. C.; Layer, N.; Löffler, H.; Stanaitis, K.; Harshad, PA; Weber, Y. G.; Hedrich, U. Long-Term Adult Human Brain Slice Cultures as a Model System to Study Human CNS Circuitry and Disease, eLife, 2019, 8:e48417. DOI: 10.7554/eLife.48417
2.Lam, M.; Lamanna, E.; Organ, L.; Donovan, C.; Bourke, JE. Perspectives on Precision Cut Lung Slices-Power-ful Tools for Investigation of Mechanisms and Thera-peutic Targets in Lung Diseases. Front Pharmacol. 2023, 14:1162889. DOI: 10.3389/fphar.2023.1162889
3. Dewyse, L.; Reynaert, H.; Van Grunsven, L. A. Best Practices and Progress in Precision-Cut Liver Slice Cultures. International Journal of Molecular Sciences, 2021, 22(13), 7137. DOI: 10.3390/ijms22137137
4. Siwczak, F.; Hiller, C.; Pfannkuche, H.; Schneider, M. Culture of Vibrating Microtome Tissue Slices as a 3D Model in Biomedical Research. J Biol Eng 2023, 17, 36 DOI: 10.1186/s13036-023-00357-5
5. Fried, N. T.; Moffat, C.; Seifert, E. L.; Oshinsky, M. L. Functional Mitochondrial Analysis in Acute Brain Sec-tions From Adult Rats Reveals Mitochondrial Dys-function in a Rat Model of Migraine. Am J Physiol Cell Physiol. 2014 Dec 1, 307(11):C1017-30. DOI: 10.1152/ajpcell.00332.2013
6. Schuh, R. A., Clerc, P.; Hwang, H.; Mehrabian, Z.; Bitt-man, K.; Chen, H.; Polster, B.M. Adaptation of Microplate-Based Respirometry for Hippocampal Slices and Analysis of Respiratory Capacity. J. Neuro-sci. Res. 2011, 89:1979–1988. DOI: 10.1002/jnr.22650
7. Underwood, E.; Redell, J. B.; Zhao, J.; Moore, A. N.; Dash, P. K. A Method for Assessing Tissue Respiration in Anatomically Defined Brain Regions. Sci Rep. 2020, 10(1):13179, DOI: 10.1038/s41598-020-69867-2
8. Qi, G.; Mi, Y.; Yin, F. Characterizing Brain Metabolic Function Ex Vivo With Acute Mouse Slice Punches. STAR Protoc. 2021, May 23; 2(2):100559. DOI: 10.1016/j.xpro.2021.100559
关于安捷伦细胞分析
安捷伦细胞分析平台包括xCELLigence RTCA实时细胞分析仪、Novocyte系列流式细胞仪、Seahorse能量代谢分析仪以及Synergy系列微孔板检测仪和Cytation 系列(共聚焦)细胞成像多功能微孔板检测仪。安捷伦细胞分析平台聚焦基础科研与细胞与基因治疗产品的开发全流程,作为适配新一代疗法的强大分析工具,提供多方位的细胞效力检测和深度的细胞分析,并致力于研发、生产质控以及临床的全方位检测与分析方案开发。

扫描二维码,关注安捷伦细胞分析






