推荐产品
公司新闻/正文
流例说——面对人类第二常见的血液系统恶性肿瘤,流式如何应对?
449 人阅读发布时间:2025-05-16 13:53
各位流式小主好,这期我们分享流式细胞仪如何应对人类第二常见的血液系统恶性肿瘤——多发性骨髓瘤。
01 我们所了解的多发性骨髓瘤(myeloma plasma,MM)
疾病概述:多发性骨髓瘤(MM)是一种克隆浆细胞异常增殖的恶性疾病,在很多国家是血液系统第 2 位常见恶性肿瘤,通常表现为存在单克隆免疫球蛋白(M 蛋白,是 MM 的标志),全球发病率呈上升趋势。MM 具有高度异质性,疾病的发展包括肿瘤细胞获得性基因改变和骨髓微环境改变。MM 常见的症状包括骨髓瘤相关器官功能损伤的表现,即 “CRAB” 症状(血钙增高、肾功能损害、贫血和骨病)以及继发淀粉样变性等相关表现。
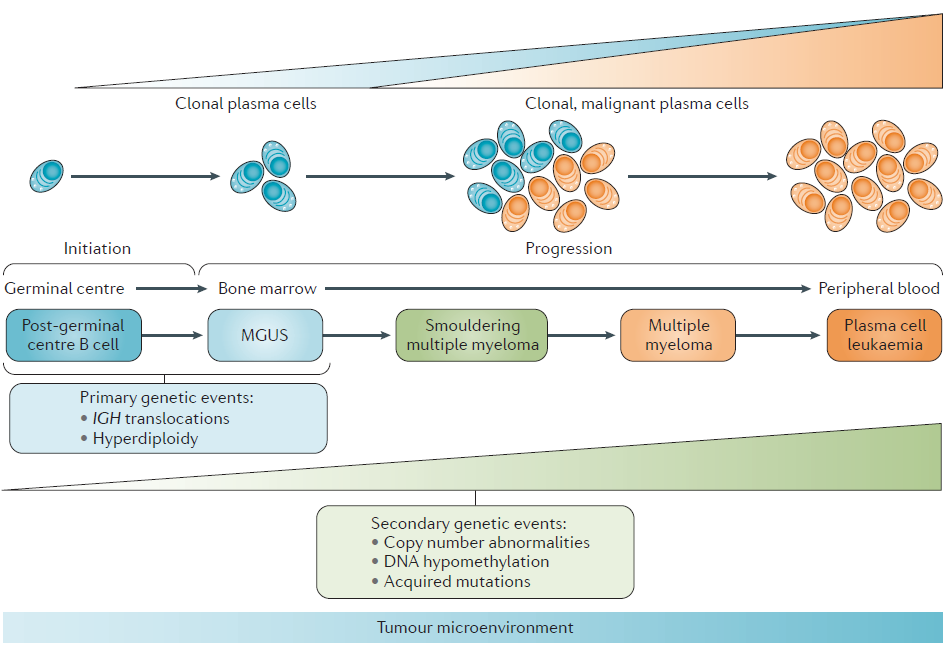
图 1. 浆细胞疾病的发展过程。无症状的意义未明的单克隆免疫球蛋白血症(MGUS)是一种无症状的癌前病变,冒烟型骨髓瘤(SMM)是 MM 的前期状态,MM 是一种终末分化的浆细胞恶性克隆性疾病,通常由 MGUS 和 SMM 发展而来。
疾病诊断:中国多发性骨髓瘤诊治指南(2024 年修订)指出:对于临床疑似 MM 的患者,应完成基本检查项目。在此基础上,有条件者可进行对诊断病情及预后分层具有重要价值的项目检测。

图 2. MM 的实验室检测项目,其中外周血流式细胞术检测恶性浆细胞百分数以及骨髓流式细胞术免疫分型可以为 MM 的诊断或预后分层提供参考。
诊断标准:综合参考美国国立综合癌症网络(NCCN)及国际骨髓瘤工作组(IMWG)的指南,意义未明单克隆免疫球蛋白增多症(MGUS)、冒烟型骨髓瘤(SMM)和活动性 MM(aMM)的诊断标准如下:

图 3. MGUS、SMM 和 aMM 的诊断标准,其中浆细胞单克隆性可通过流式细胞术、免疫组织化学染色及免疫荧光的方法鉴定其轻链 κ/λ 限制性表达。
02 MM 的诊疗,且看流式细胞术放大招
免疫分型
诊断和鉴别诊断
流式细胞术通过检测细胞的免疫表型、FSC 和 SSC 的散射光信号等可以对正常的、反应性与肿瘤性浆细胞进行区分和计数。大多数骨髓正常浆细胞不表达 CD20 或 CD22 等泛 B 细胞标记物,缺乏表面膜免疫球蛋白(smIg),且胞质轻链(cyκ、cyλ)非限制性表达。此外,正常浆细胞 CD19、CD27、CD45 和 CD81 呈异质性表达。肿瘤性浆细胞与正常浆细胞相比表现出不同的表型特征,通常表现为:
1)CD19、CD27、CD38、CD45 和 CD81 表达不足
2)CD28、CD33、CD56、CD117 和 CD200 过表达;
3)CD20 和 SmIg 表达不同步。
下图总结了常见的肿瘤性浆细胞的异常表型特征。
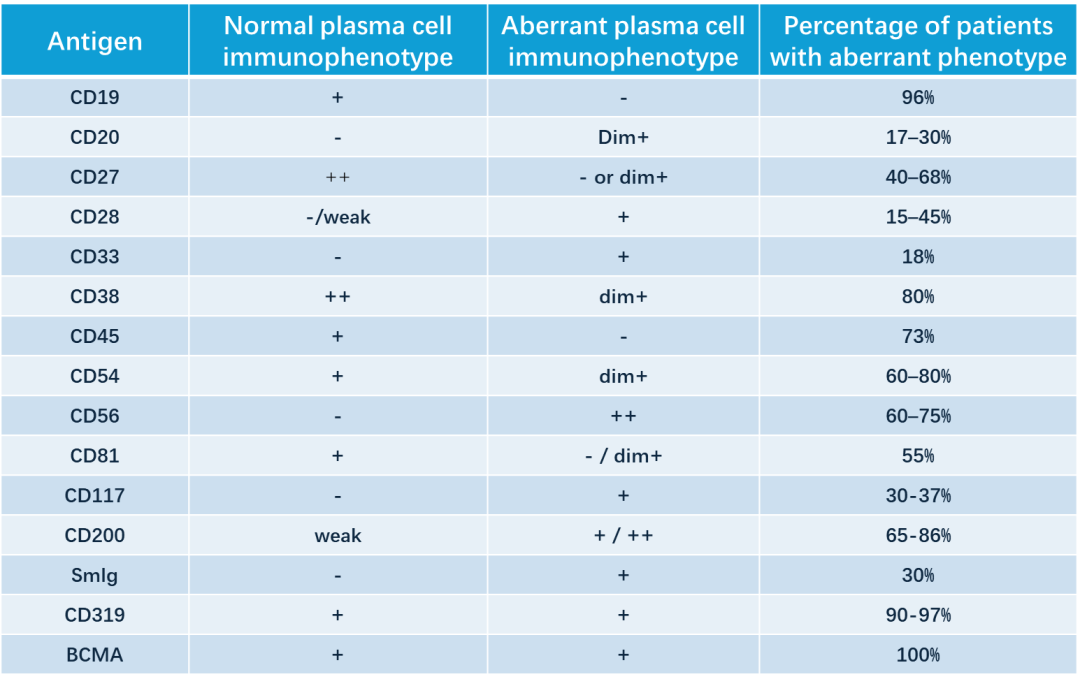
图 4. 常见的肿瘤性浆细胞的异常表型特征
由于 MGUS、SMM 和 MM 的治疗方案不同,因此鉴别诊断非常重要。浆细胞肿瘤骨髓中常同时存在正常和异常浆细胞,正常浆细胞占骨髓总浆细胞的比值 NPC/BMPC≥5% 有助于 MGUS 与 MM 的鉴别诊断、评估 MGUS 和 SMM 向 MM 转化的危险程度以及识别预后良好的 MM。Pérez-Persona 等的研究结果显示,80% 以上的 MGUS 患者骨髓中 NPC/BMPC>5%,仅少数 MM 患者(<15%)骨髓中 NPC/BMPC>5%,因此通过流式细胞术检测,初诊时骨髓 NPC/BMPC 有助于 MGUS 与 MM 的鉴别诊断。
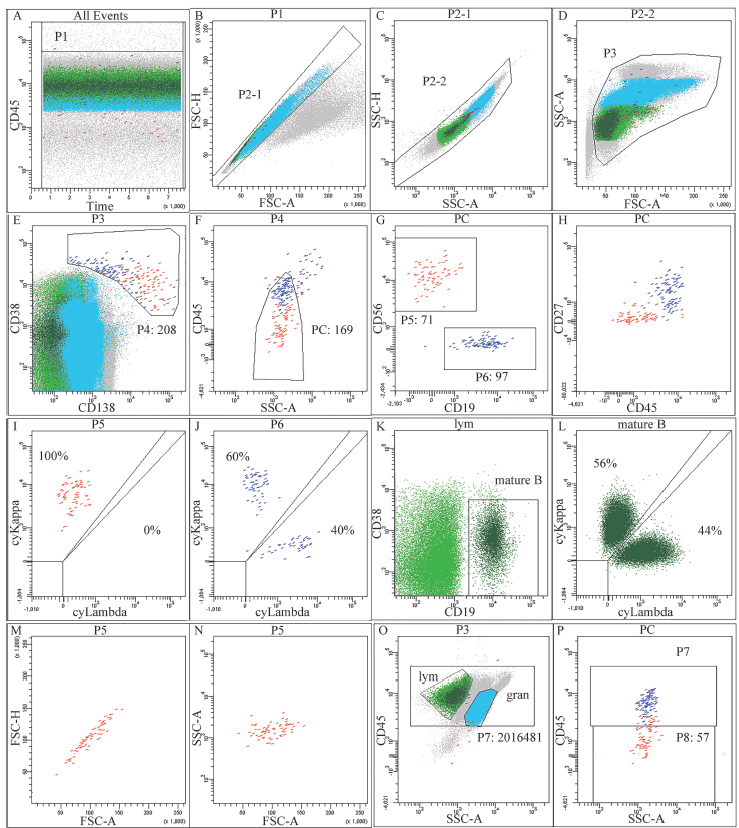
图 5: MM 外周血检测流式示例图和设门分析策略:CD45/SSC 联合 CD38/CD13 精确圈出浆细胞群,根据 CD56、CD19、CD27 以及胞浆 Kappa/Lambda 表达情况分析表型异常的单克隆浆细胞(红色),正常表型的浆细胞(蓝色),根据 CD19/CD38 分析成熟的 B 淋巴细胞。
大海捞针,异常无处遁形
MM 微小残留病(MRD)检测
多参数流式细胞术作为 MM MRD 的重要检测手段,具有以下优势:
1)以异常表型为基础区分正常和异常浆细胞,几乎适用于所有 MM 患者,不需要初诊时的表型,而且也不会受单克隆 B 细胞的影响;
2)可在一个样本中分析不同的细胞群,根据不同的表型可对任意异常细胞群进行检测和跟踪;
3)检测时间短,费用适宜,灵敏度高。MSKCC 采用包括 CD45/CD138/CD38/CD56/CD19/CD27/CD117/CD81/CyIgκ/CyIgλ 等 10 个参数的单管方案,至少采集 3×106 个细胞,其检测的灵敏度高达 6×10-6。为了推进 MM MRD 检测和分析的标准化和规范化,2024 年国内推出了《基于骨髓样本的多发性骨髓瘤微小残留病检测中国专家共识(2024 年版)》。
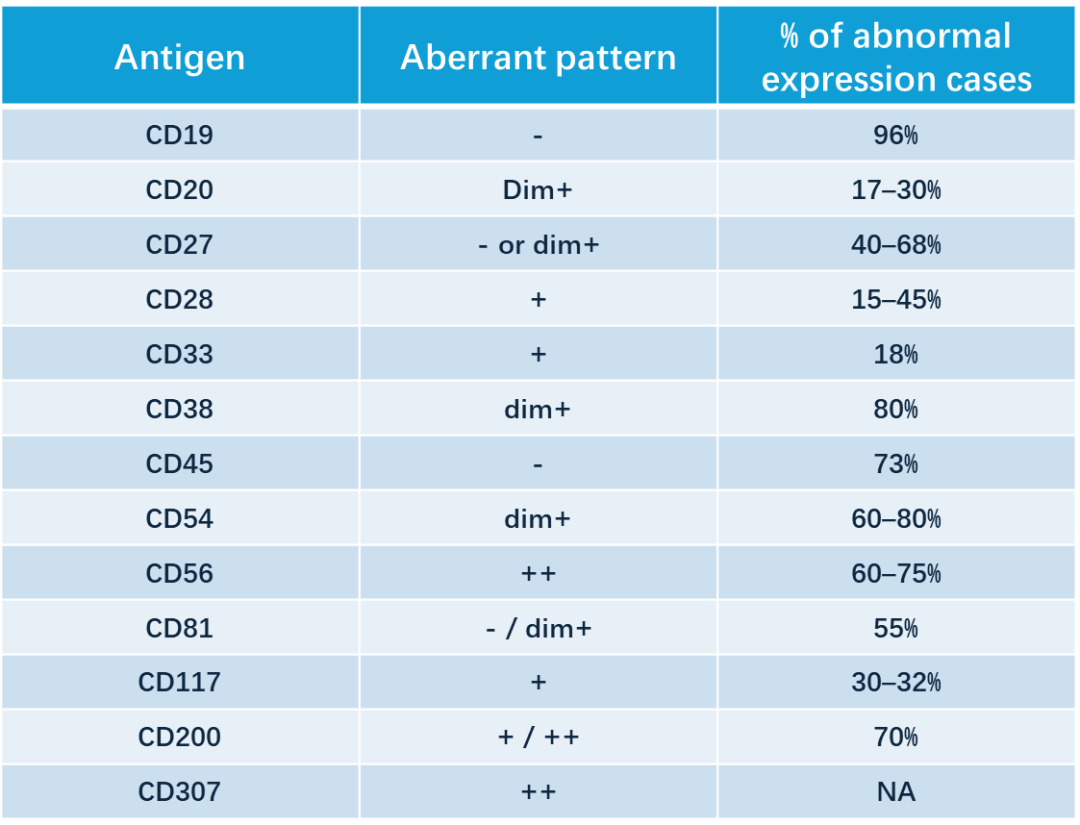
图 6: MM MRD 常用的抗体及肿瘤性浆细胞常见的异常表型

图 7: MM MRD 推荐的检测骨架抗体及备选抗体组合
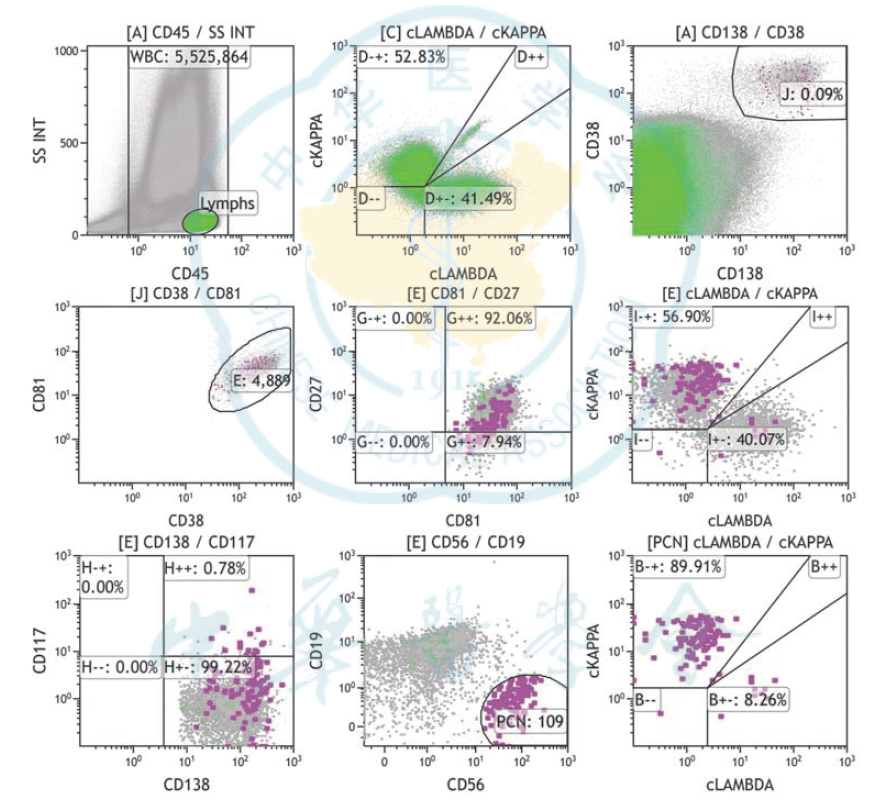
图 8: MM MRD 流式检测示例图。分析 553 万个白细胞,可见 109 个单克隆浆细胞(表型为 CD38++CD138++CD19-CD56+CD117-CD81+CD27±cKappa+cLambda-CD45±),MRD=2.0×10-5
靶向 CD38 、CD319 的单克隆抗体(如达雷妥尤单抗等)会干扰流式细胞术对浆细胞的识别,导致假阴性结果。因此,建议应用此类药物患者关注 CD138+CD38- 细胞群或使用多表位 CD38Me、CD38 纳米单抗或 VS38c 等代替常规 CD38 来识别浆细胞;也可结合其他抗体如 CD229、CD54 与 CD45、CD138 等帮助作为单抗治疗后的浆细胞圈门分析。
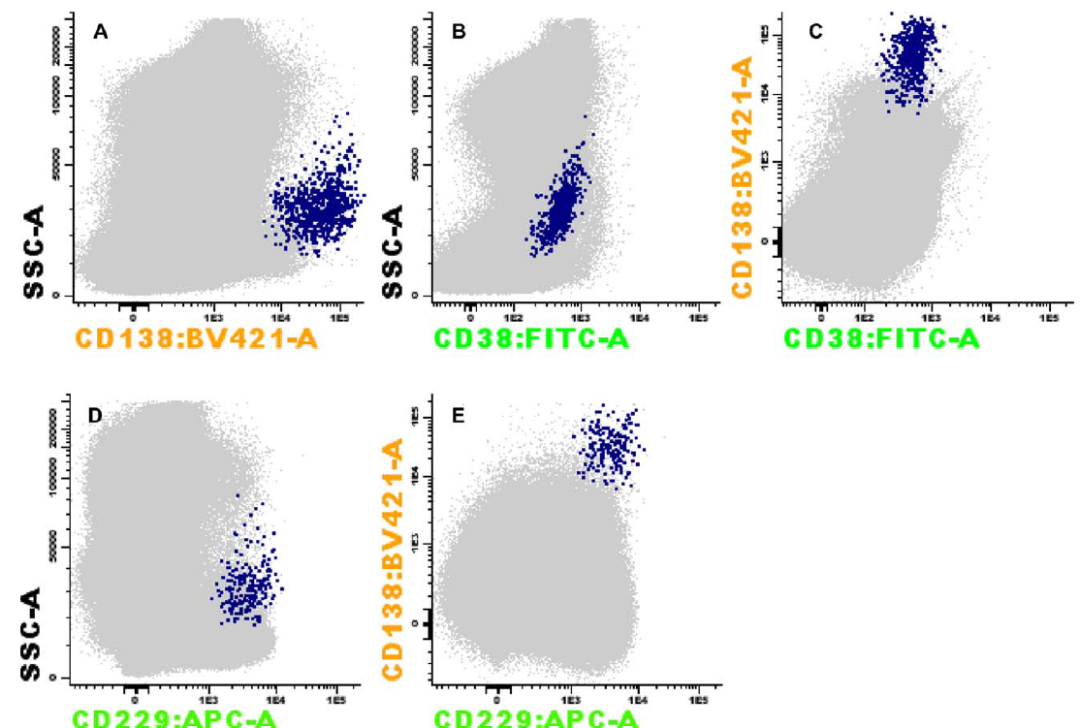
图 9: 接受抗 CD38(达雷妥尤单抗)治疗的患者骨髓流式检测图。E: CD138 结合 CD229 的可以更准确地区分整个浆细胞群。
肿瘤逃逸
外周血循环浆细胞(circulating plasma cells,CPCs)
浆细胞病是一个发生发展的过程,随着疾病发展,肿瘤性浆细胞从骨髓进入外周血,形成外周血 CPCs,在肿瘤远处播散中起到重要作用。CPCs 可反映肿瘤生物学和肿瘤免疫微环境特征。在浆细胞病治疗前后及随访过程中采用 FCM 检测 CPCs,有助于判断预后、改良现有模型风险分层能力、预测疾病进展、疗效评估、指导治疗方案和选择、以及辅助早期筛查和干预。
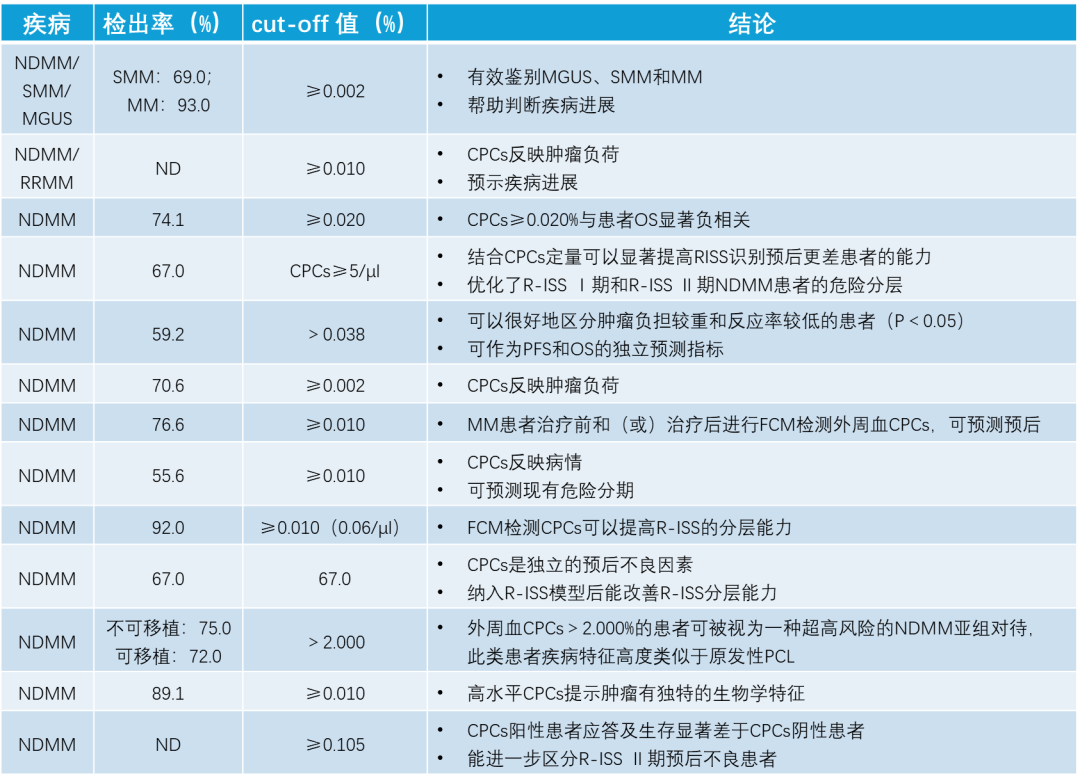
图 10: MM 外周血循环浆细胞的临界值与研究结论

图 11:外周血循环浆细胞辅助 MM 的预后评估与危险分层
何时自体造血干细胞移植?
CD34+ 造血干细胞计数
目前新诊断 MM 的治疗原则为高龄和肾功能不全并非移植的绝对禁忌证,如年龄 >70 岁但全身体能状态评分良好的患者,自体造血干细胞移植(ASCT)仍可为首/选。MM 患者自体造血干细胞移植(ASCT)前需进行干细胞动员,每次 ASCT 所需 CD34+ 细胞数建议 ≥2×106/kg 体重,理想细胞数是 5×106/kg 体重。流式细胞术因操作简便、快速准确成为造血干细胞计数的重要方法,此外流式细胞术动态监测免疫重建还可以帮助预测 ASCT 的疗效。
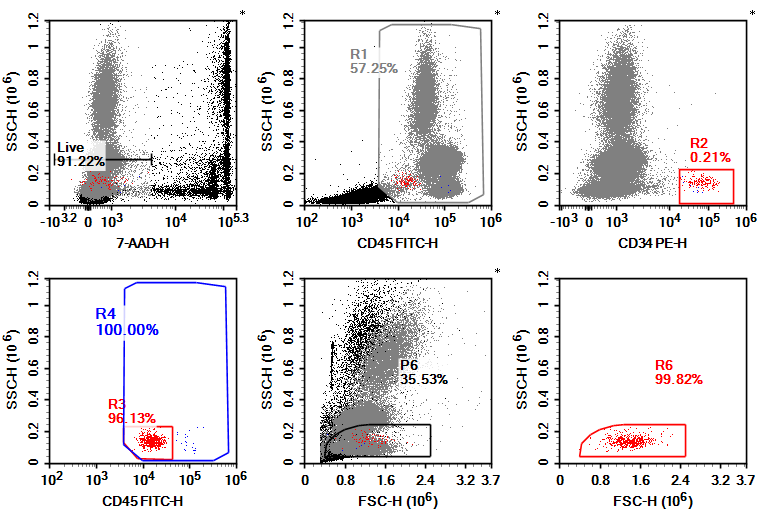
图 12: CD34+ 造血干细胞流式细胞术检测图
锁定目标,定向攻破
MM 靶向治疗
流式细胞术不仅在 MM 的诊断、预后和疗效评估中发挥重要作用,同时也为 MM 治疗的靶向药物和免疫药物的研发、临床试验、预后监测和疗效评估提供了必不可少的依据。目前针对 MM 靶向治疗策略主要包括三大类:抗体介导的细胞毒性药物、T 细胞介导的抗肿瘤治疗和 CAR-T 治疗;处于研究中的靶向相关抗原包括 CD19、CD38、CD138、BCMA、kappa 轻链、SLAM7、NKG2D 和 GPRC5D 等。
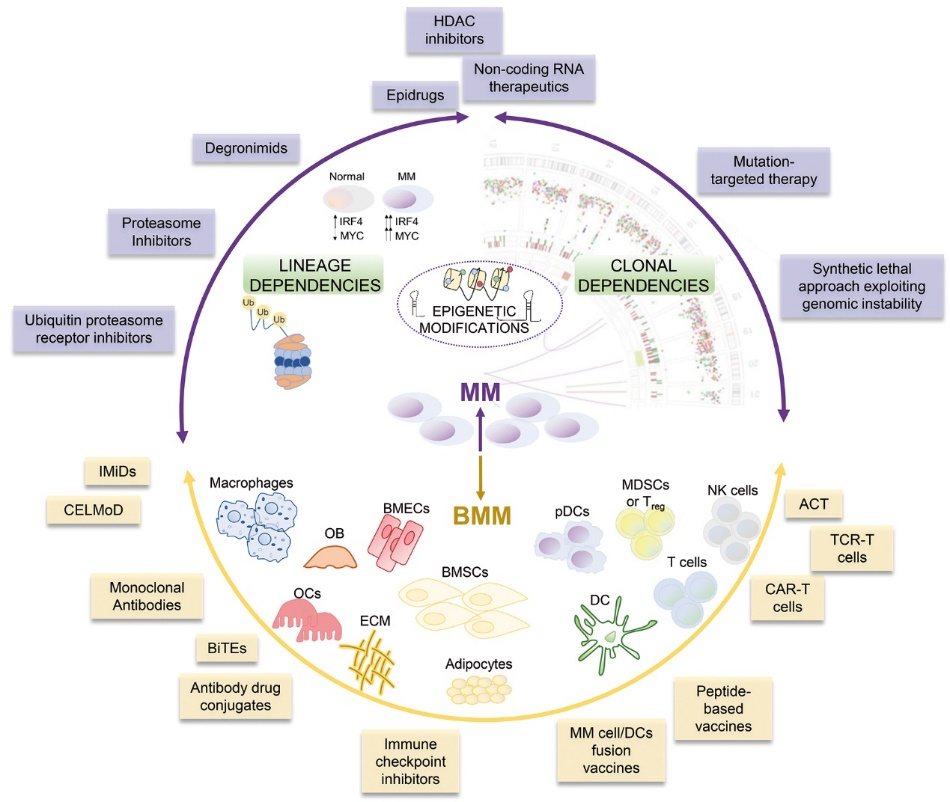
图 13: MM 的靶向治疗策略
流式细胞术在 CAR-T 细胞的设计构建、患者入组、CAR-T 细胞产品的性能检测、疗效评价、免疫功能评价、复发机制研究与后续治疗方案的选择等各个环节都起到重要的作用。
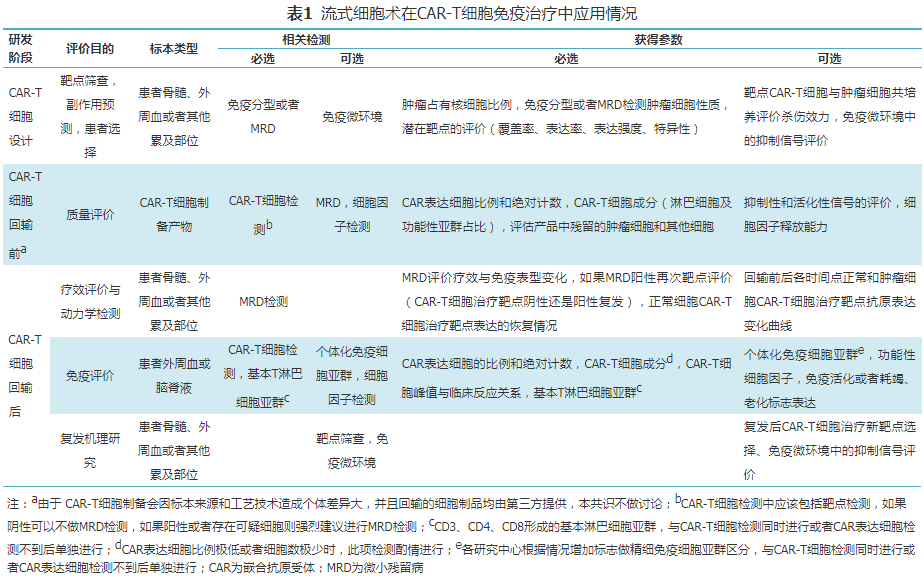
图 14:流式细胞术在 CAR-T 细胞治疗中的相关检测和意义
03 MM 流式检测的临床项目意义与应用小结
FCM 通过免疫分型、各类细胞计数、靶点研究、免疫评估为 MM 的病理研究、早期筛查、诊断和鉴别诊断、疗效评价、预后评估、危险分层、疾病进展、精准治疗等提供必不可少的依据。
04 流式细胞仪及其配套解决方案
可检测样本
骨髓、外周血、淋巴结、细针穿刺、脑脊液、胸腹水、血清、血浆等标本
仪器和试剂
1)具备国际认可的标准化方案或专家共识中推荐的荧光染料标记和克隆号的流式检测抗体;
2)具备智能、多色、高性能的流式细胞仪,可满足稀有样本、多参数同时检测的需求;
3)部分机型支持样本回收功能,剩余的未被检测样本可自动回收至样本管内进行保存或进一步检测,对稀有样本友好;
4)高精度注射泵上样,样本体积精确控制,无需任何耗材直接绝对计数;
5)可选配自动上样器,实现孔板和试管架上批量样本的自动快速采集;
6)提供自动化的仪器 QC 测试功能,并跟踪一段时间的测试结果,确保提供一致的结果;
7)提供自动、手动两种荧光补偿方法,可以方便快速地实现多个荧光通道之间的正确补偿;
8)配套 DNA、淋巴细胞亚群、细胞因子等分析软件;此外采集样本并分析数据后可导出为模板文件,简化后续分析步骤、减少重复工作、提高工作效率。
此文仅供科普,对患者的临床诊治应结合其症状/体征、病史、其它实验室检查及治疗反应等情况综合考虑。
参考资料
1. 刘艳荣. 实用流式细胞术——血液病篇(第2版)[M] 北京: 北京大学医学出版社; 2023.
2. 中国医师协会血液科医师分会, 中华医学会血液学分会. 中国多发性骨髓瘤诊治指南(2024年修订)[J]. 中华内科杂志, 2024, 63(12): 1186-1195.
3. Flores-Montero J, de Tute R, Paiva B, Perez JJ, Böttcher S, Wind H, Sanoja L, Puig N, Lecrevisse Q, Vidriales MB, van Dongen JJ, Orfao A. Immunophenotype of normal vs. myeloma plasma cells: Toward antibody panel specifications for MRD detection in multiple myeloma. Cytometry B Clin Cytom. 2016 Jan;90(1):61-72.
4. Kumar, S., Rajkumar, V., Kyle, R. et al. Multiple myeloma. Nat Rev Dis Primers 3, 17046 (2017).
5. Sheykhhasan, M., Ahmadieh-Yazdi, A., Vicidomini, R. et al. CAR T therapies in multiple myeloma: unleashing the future. Cancer Gene Ther 31, 667–686 (2024).
6. Gulla A, Anderson KC. Multiple myeloma: the (r)evolution of current therapy and a glance into future. Haematologica. 2020 Oct 1;105(10):2358-2367.
7. Pérez-Persona E, Vidriales MB, et al. New criteria to identify risk of progression in monoclonal gammopathy of uncertain significance and smoldering multiple myeloma based on multiparameter flow cytometry analysis of bone marrow plasma cells. Blood. 2007 Oct 1;110(7):2586-92. doi: 10.1182/blood-2007-05-088443. Epub 2007 Jun 18. PMID: 17576818.
8. 中华医学会血液学分会实验诊断学组、浆细胞疾病学组,中国医师协会多发性骨髓瘤专业委员会. 基于骨髓样本的多发性骨髓瘤微小残留病检测中国专家共识(2024年版)[J]. 中华血液学杂志,2024,45(06):534-541.
9. 中国医师协会血液科医师分会,中华医学会血液学分会. 嵌合抗原受体T细胞治疗多发性骨髓瘤中国血液临床专家共识(2022年版)[J]. 中华血液学杂志,2022,43(04):265-271.
关于安捷伦细胞分析
安捷伦细胞分析平台包括xCELLigence RTCA实时细胞分析仪、Novocyte系列流式细胞仪、Seahorse能量代谢分析仪以及Synergy系列微孔板检测仪和Cytation 系列(共聚焦)细胞成像多功能微孔板检测仪。安捷伦细胞分析平台聚焦基础科研与细胞与基因治疗产品的开发全流程,作为适配新一代疗法的强大分析工具,提供多方位的细胞效力检测和深度的细胞分析,并致力于研发、生产质控以及临床的全方位检测与分析方案开发。

扫描二维码,关注安捷伦细胞分析






