推荐产品
公司新闻/正文
安捷伦 Seahorse XF Flex 分析仪应用简报:准确评估脂肪细胞分化过程中的代谢重编程
324 人阅读发布时间:2025-06-26 10:58
摘要
线粒体在细胞功能中发挥着至关重要的作用。它们不仅负责维持细胞生物能量需求,而且在感知和响应环境信号方面也发挥着关键作用。事实上,许多疾病都与线粒体功能障碍有关,包括多种神经退行性疾病以及糖尿病、心血管疾病、肌肉和肾脏疾病等慢性疾病。脂肪细胞中的线粒体功能障碍会引发肥胖和 II 型糖尿病等代谢性疾病,具体表现为:脂质代谢能力下降、氧化应激反应增强,最终导致全身代谢系统失衡。在脂肪细胞分化过程中,线粒体活性会动态调整,以适应不断变化的代谢需求。虽然安捷伦 Seahorse XF 分析仪是体外线粒体功能评估的常用工具,但由于脂肪细胞分化过程中代谢率显著增加,监测成熟脂肪细胞的代谢表型仍具有挑战性。本应用简报介绍了一种将标准安捷伦 Seahorse XFe24/XF Flex V7 PS 培养微孔板和安捷伦 Seahorse XFe24/XF Flex V28 培养微孔板搭配安捷伦 Seahorse XF Flex 分析仪的优化工作流程,用于在体外细胞分化过程中进行准确的代谢分析。这两种微孔板的组合扩展了仪器的检测范围,能够以高精度和高准确度捕获多个分化阶段的各种代谢活动。
脂肪细胞线粒体功能对于能量稳态、脂质代谢和胰岛素敏感性至关重要。线粒体功能障碍会导致脂质异常堆积、胰岛素抵抗和氧化应激增加,从而引发肥胖和 II 型糖尿病[1,2]。安捷伦 Seahorse XF 分析仪广泛应用于线粒体功能的体外和离体评估。然而,由于脂肪细胞分化后代谢率显著增加,对成熟脂肪细胞的线粒体功能及生物能量代谢表型进行持续定量监测仍存在挑战。
3T3-L1 成纤维细胞在培养条件下,经特定诱导剂组合处理后,可以分化为成熟的脂肪细胞,是研究脂肪生成、脂肪细胞代谢及相关疾病机制的重要工具。在 3T3-L1 分化为成熟的脂肪细胞期间,培养的细胞需先达到汇合状态并维持两天,随后进入分化诱导阶段。在分化阶段的前两天,细胞会经历一到两轮增殖,最终的汇合度远高于大多数贴壁细胞类型。此外,随着 3T3-L1 脂肪细胞成熟,PGC-1α 表达显著升高,达到与棕色脂肪组织相当的水平[3],从而进一步增强了线粒体呼吸作用。这些因素会使细胞呼吸速率变得非常高(每孔耗氧率高)。由于这类细胞的呼吸速率较高,当使用标准安捷伦 Seahorse XFe24/XF Flex V7 PS 培养微孔板 (XF V7)(部件号 100777-004)培养细胞并进行 Seahorse XF 速率测量时,微室内会出现缺氧现象。这种缺氧常常导致耗氧率 (OCR) 被低估,以及两次测量之间氧浓度无法充分恢复。
安捷伦 Seahorse XFe24/XF Flex V28 PS 培养微孔板 (XF V28)(部件号 100882-004)也是一款 24 孔板,但微室容量更大(XF V28 为 22 µL,而 XF V7 为 5.65 µL),可用于呼吸作用较强的细胞,同时它的孔表面积与标准 XF V7 微孔板相同。当 XF V28 微孔板与安捷伦 Seahorse XF Flex 分析仪搭配使用时,可为呼吸作用较强的样品提供定制测量程序。微室容量更大,则氧气储备更充足;增强的混合程序可大幅减少微室缺氧现象,从而提高呼吸作用较强的细胞的整体检测准确性。
在本应用简报中,我们开发了一种优化工作流程,使用 Seahorse XF Flex 分析仪准确测定不同体外分化阶段脂肪细胞的代谢特征。标准 XF V7 微孔板与 XF V28 微孔板结合使用,搭配 Seahorse XF Flex 分析仪的优化检测方案和出色检测性能,进一步扩大了检测范围,能够准确表征脂肪细胞从早期分化阶段到完全成熟的各个阶段的代谢表型。
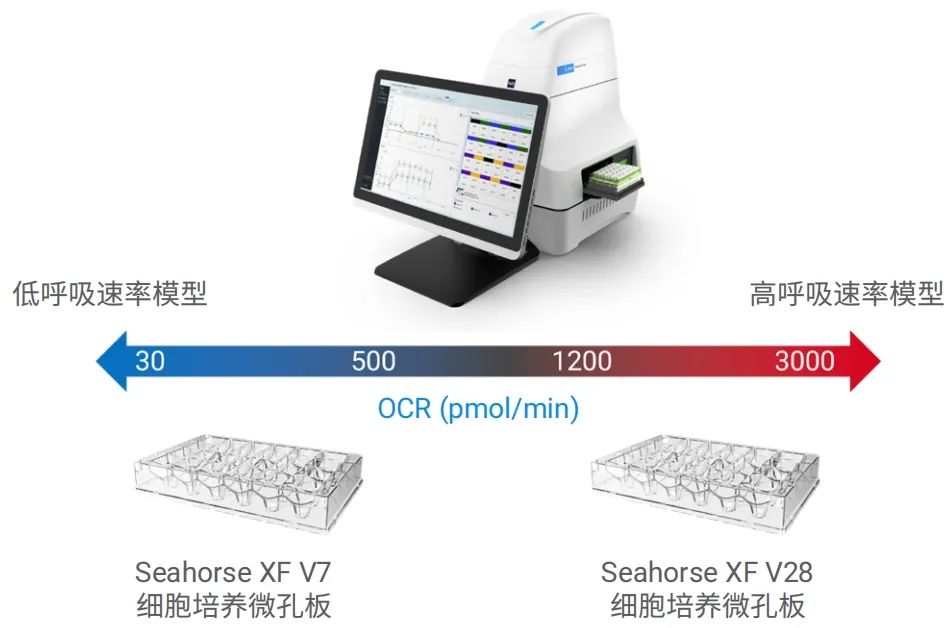
图 1. 通过结合使用 XF V7 和 XF V28 微孔板,Seahorse XF Flex 分析仪可实现的检测范围
实验部分
3T3-L1 成纤维细胞的细胞培养和脂肪分化
3T3-L1 成纤维细胞购自 ATCC (CL-173)。使用含有 10% 小牛血清(ATCC,30-2030)的 DMEM(Gibco,11995)培养细胞,并在达到 80% 汇合度后进行传代培养。接种前,将标准 XF V7 微孔板(部件号 100777-004)或 XF V28 微孔板(部件号 100882-004)的每个孔用 100 µL 0.2% 明胶(Sigma,G1393)进行过夜包被处理。对于亚汇合状态下的实验,每孔接种 10000 个细胞,并于次日检测。对于第 0 天 (d0) 及后续分化阶段的检测,每孔接种 20000 个细胞,通常可在 2 天内达到汇合状态。

图 2. 使用 Agilent BioTek Cytation 5 细胞成像多功能微孔板检测系统采集的 3T3-L1 细胞分化前 (d0)、分化期间 (d3) 和成熟脂肪细胞 (d6 及之后) 的相差图像(放大 10 倍)。比例尺 = 200 µm
达到完全汇合的两天后 (d0),使用添加了 10% FBS(HyClone,SH30070.03)、0.5 mM IBMX(Sigma ,I5879)、5 µM 罗格列酮(Sigma ,R2408)、1 µM 地塞米松(Sigma ,D4902)和 200 nM 胰岛素(Sigma ,I9278)的 DMEM 诱导分化。诱导分化两天后,即第 2 天 (d2),将分化培养基替换为含有 10% FBS 和 200 nM 胰岛素的 DMEM。从第 4 天开始,使用含 10% FBS 和 20 nM 胰岛素的 DMEM 分化培养基培养细胞,每 1 至 2 天更换一次新鲜培养基。
Seahorse XF 检测
XF V7 微孔板中开展的所有实验均采用检测模板的默认方案条件(混合 3 分钟、等待 2 分钟、测量 3 分钟)。对于安捷伦 Seahorse XFe24 分析仪, XF V28 微孔板同样使用默认方案(混合 3 分钟、等待 2 分钟、测量 3 分钟)。对于 Seahorse XF Flex 分析仪,XF V28 微孔板的实验方案调整为混合 3 分钟、等待 0 分钟、测量 4 分钟,以尽可能提高强呼吸作用样品的氧气恢复,但以下步骤除外,即添加 FCCP 之后和添加鱼藤酮/抗/霉素 A 之前,这个步骤的测量方案为混合 3 分钟、等待 0 分钟、测量 2.5 分钟(图 3)。
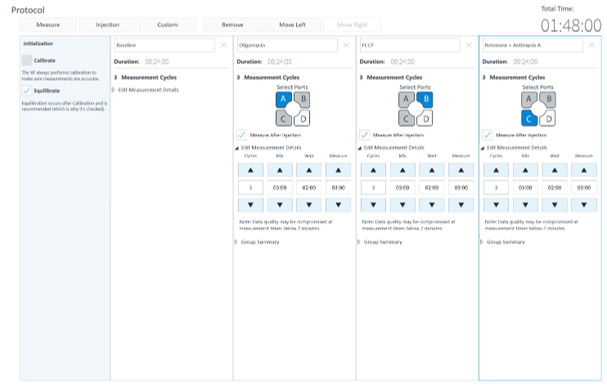
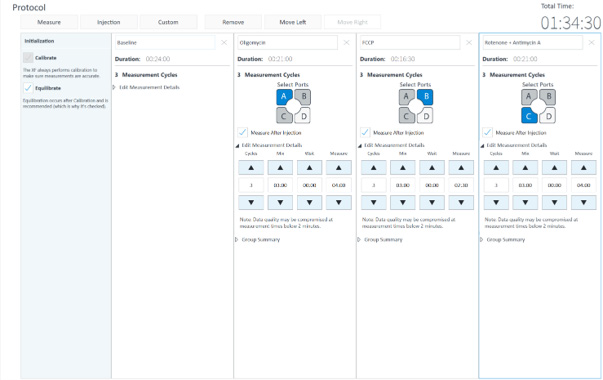
图 3. 用于 XF V7 (A) 和 XF V28 ― Seahorse XF Flex (B) 检测的 Seahorse XF 细胞线粒体压力测试方案条件
使用安捷伦 Seahorse XF 细胞线粒体压力测试试剂盒(部件号 103015-100) 对亚汇合和汇合后 (d0) 的前脂肪细胞以及分化后第 3、6 和 9 天的细胞进行检测。根据用户指南中的建议,针对每个分化阶段优化了 FCCP 浓度。检测中使用的最终试剂浓度为:2.5 µM 寡霉素 (Oligo)、2 µM FCCP 和 1 µM 鱼藤酮/抗/霉素 A (R/A),但亚汇合的 3T3-L1 细胞除外,该细胞使用 1.5 µM FCCP。
使用安捷伦 Seahorse XF 底物氧化压力测试试剂盒 (部件号 103672-100 、103673-100 、103674-100),按照试剂盒用户指南对亚汇合细胞、 d0 前脂肪细胞和第 6 天 (d6) 的成熟脂肪细胞进行检测。检测过程中所用的寡霉素、FCCP 和鱼藤酮/抗/霉素 A 的浓度与之前在 Seahorse XF 细胞线粒体压力测试中优化的浓度相同。
对于亚汇合状态的 3T3-L1 细胞,使用基于 Hoechst 核染色的细胞计数结果进行归一化。在分化后期阶段,由于细胞堆叠和多层结构的形成,核染色方法的可靠性降低;因此,使用蛋白质浓度进行数据归一化。
结果与讨论
XF V7 微孔板的优势和局限性
XF V7 微孔板在速率测量期间会形成 5.65 µL 的瞬态微室,可实现高灵敏度检测,非常适合用于研究大多数细胞类型(包括 3T3-L1 前脂肪细胞)的呼吸作用。这一点通过检测过程中观察到的氧气水平变化可以证明(图 4A),我们注意到每次测量期间氧气的斜率相对恒定且氧气消耗适度。无论是基础测量期间还是加入 FCCP 后,都能在混合程序后观察到检测液中氧气浓度实现有效恢复,从而确保 XF 细胞线粒体压力测试能够获得准确的典型 OCR 动力学曲线(图 4B)。
然而,当使用 V7 孔板对成熟脂肪细胞(第 6 天)进行类似实验,或在代谢活性显著升高的脂肪成熟过程中进行类似实验时,细胞外检测液中的初始氧气浓度明显较低(约为 75 mmHg,而预期约 150 mmHg)。即使在基础条件下,测量期间氧气依然近乎完全耗竭(图 4C)。此外,加入 FCCP 后,由于线粒体解偶联导致 OCR 增加,缺氧状况进一步加重。缺氧导致两次测量之间氧气浓度无法完全恢复,从而导致备用呼吸能力 (SRC) 出现错误的负值(图 4C 和 4D),并导致 OCR 测定结果不准确。这些问题表明了在 XF 检测过程中监测氧气浓度的重要性,以便识别高呼吸速率的细胞模型,通过优化检测条件实现准确的代谢分析。
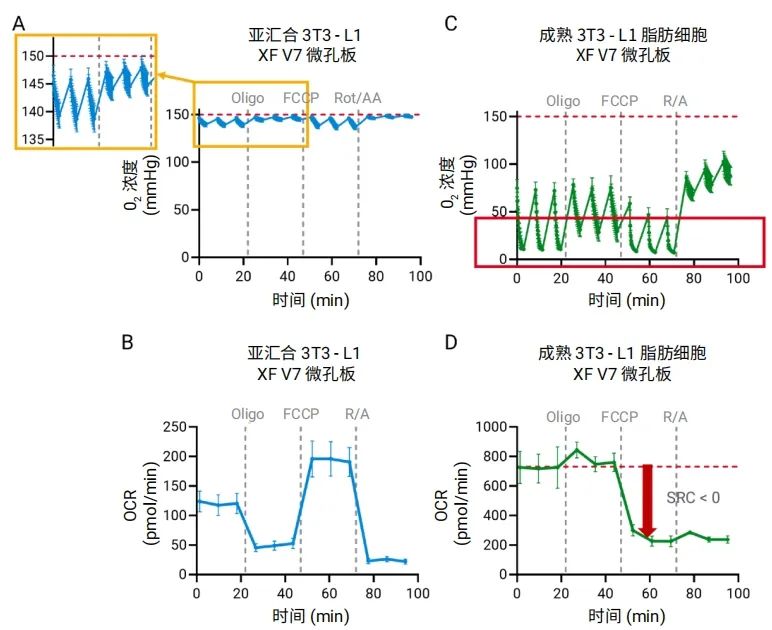
图 4. 使用 XF V7 微孔板和 Seahorse XF Flex 分析仪对亚汇合 3T3-L1 成纤维细胞(A、B)和成熟脂肪细胞(C、D)进行的 Seahorse XF 细胞线粒体压力测试比较。成熟脂肪细胞的强呼吸作用导致测量过程中氧气严重耗竭(红色框),使最大呼吸被低估,最终导致备用呼吸能力计算出现错误的负值(红色箭头)
使用 XF V28 微孔板和 Seahorse XF Flex 分析仪改进强呼吸细胞的 OCR 测量
为了优化强呼吸作用细胞模型的生物能量代谢测量,我们使用 Seahorse XF Flex 分析仪对在 XF V28 微孔板中分化的成熟脂肪细胞 (d6) 进行了平行研究。如图 5A 所示,XF V28 微孔板的微室体积更大,有助于在测量期间使氧气浓度保持在建议范围内(氧气 > 50 mmHg),有效避免了使用 XF V7 孔板时观察到的缺氧现象(图 4C)。此外,Seahorse XF Flex 分析仪针对 XF V28 微孔板调整了混合程序,改善了两次测量之间微室内的氧气恢复情况(图 5A),防止氧气过度耗竭, 可生成可靠的 XF 细胞线粒体压力测试动力学曲线(图 5B),包括加入 FCCP 后预期的 OCR 增加和备用呼吸能力为正值 (SRC >0)。
相反,当在 Seahorse XFe24 分析仪上使用默认混合程序和仪器检测方案分析 XFV28 微孔板中培养的相同细胞时(图 5C),由于混合参数不理想,观察到氧气恢复不足。这导致线粒体功能表征不准确(图 5D)。
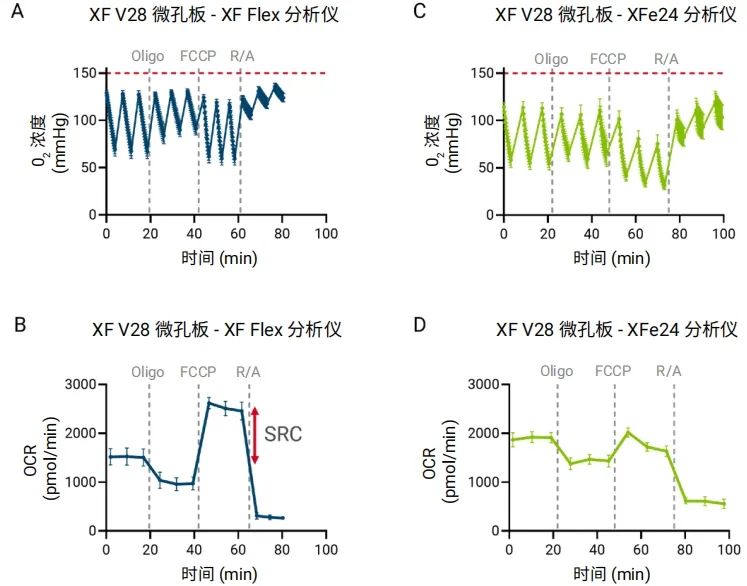
图 5. 使用 Seahorse XF Flex 分析仪(A 和 B)和 Seahorse XFe24 分析仪(C 和 D) 与 XF V28 微孔板对成熟 3T3-L1 脂肪细胞(第 6 天)进行 Seahorse XF 细胞线粒体压力测试的结果比较。Seahorse XF Flex 分析仪采用针对 XF V28 微孔板优化的混合程序和方案,能够准确测定最大呼吸,并获得了正值的备用呼吸能力(SRC;红色箭头)
总体而言,使用 XF V28 微孔板和 Seahorse XF Flex 分析仪可以准确测量高活性细胞的代谢特征。对各种细胞类型的 进一步研究表明,XF V7 微孔板的最佳 OCR 测量范围约为 30–1200 pmol/min,而 XF V28 微孔板能够可靠地测量高达 3000 pmol/min 的 OCR。然而,不建议将 XF V28 微孔板用于基础 OCR 低于 500 pmol/min 的细胞,因为灵敏度不足且噪音增加会导致数据变异性较大。

表 1. XF V7 和 XF V28 微孔板的推荐 OCR 和氧气浓度
结合使用 XF V7 和 XF V28 微孔板准确分析脂肪细胞各分化阶段的代谢特征
如前所述,有丝分裂克隆扩增对于 3T3-L1 细胞的脂肪生成至关重要,这一过程发生在分化的前两日。从第三天起,细胞停止增殖,而分化为成熟脂肪细胞的过程持续进行。这一过程伴随着细胞质量增加和 PGC1α 表达显著上升[3] ,导致每孔耗氧率大幅升高,线粒体活性发生显著变化。为准确表征脂肪细胞分化过程中的生物能量代谢变化,需根据 OCR 范围和不同分化阶段选择使用 XF V7 和 XF V28 微孔板获得相应数据。通过比较分析不同分化时间点的结果,我们发现,前脂肪细胞最适合使用 XF V7 孔板,而从第三天起,使用 XF V28 微孔板可以获得更可靠的测量结果(图 6A–D)。此外,在各阶段均对 FCCP 滴定进行了优化,以确保准确测定最大呼吸和备用呼吸能力 (SRC)。
如图 6A–D 所示,基础 OCR 和最大 OCR 均随分化进程增加。然而,当基于蛋白质含量进行归一化时,成熟脂肪细胞(第六天和第九天)的 ATP 关联呼吸和 SRC 明显低于第三天(图 6E–F)。造成这一结果的原因在于,尽管细胞数量稳定,但随着细胞成熟,总蛋白含量持续上升[4]。
这些研究结果表明了脂肪生成过程中线粒体的适应性,并证明了 XF V7 和 XF V28 微孔板结合使用的价值:可准确监测不同分化阶段的动态代谢变化。
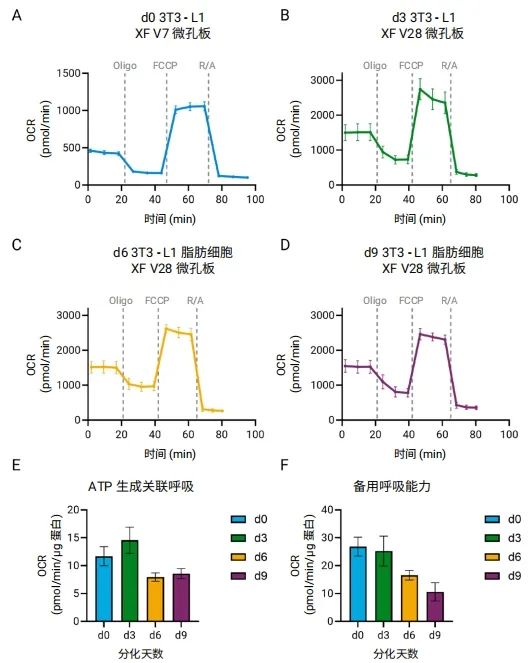
图 6. 在 Seahorse XF Flex 分析仪上使用 XF V7 和 XF V28 微孔板对分化过程中的 3T3-L1 细胞进行 Seahorse XF 细胞线粒体压力测试。(A–D) d0 前脂肪细胞 (A)、d3 分化细胞 (B) 和 d6 (C) 及 d9 (D) 成熟脂肪细胞的 OCR 动力学曲线。不同分化阶段的 (E) ATP 生成关联呼吸和 (F) 备用呼吸能力,均根据总蛋白含量进行了归一化
底物氧化压力测试揭示了成熟前和成熟 3T3-L1 脂肪细胞的底物依赖性差异
葡萄糖、脂肪酸和氨基酸是各类细胞用来支持线粒体呼吸作用的主要底物。为了评估细胞对各种底物的相对依赖性,我们使用特定的代谢抑制剂进行了底物氧化压力测试:UK5099 (一种线粒体丙酮酸载体抑制剂)、Etomoxir(一种阻断长链脂肪酸氧化的 CPT1α 抑制剂)和 BPTES(一种针对谷氨酰胺氧化的谷氨酰胺酶抑制剂)。按照 XF 底物氧化压力测试用户指南,在使用 Seahorse XF 线粒体压力测试试剂之前加入这些抑制剂。我们发现,亚汇合 3T3-L1 成纤维细胞对所有三种抑制剂均较为敏感,当葡萄糖、脂肪酸或谷氨酰胺代谢受到抑制时,其最大呼吸呈现相似程度的降低(图 7A、E)。相比之下, d0 前脂肪细胞对葡萄糖和脂肪酸氧化的依赖性更大,对谷氨酰胺抑制的反应较温和(图 7B、 F)。另一方面,成熟脂肪细胞表现出独特的代谢模式:暴露于 UK5099 和 BPTES 导致基础呼吸速率快速、短暂下降,同时伴随糖酵解活性的补偿性升高,如 OCR 和 ECAR 动力学曲线所示(图 7C-D)。然而,这些细胞会迅速适应,最终在抑制剂存在下,最大呼吸未发生显著变化(图 7G)。
总之,使用 V7 孔板检测前脂肪细胞,使用 V28 孔板检测成熟脂肪细胞,可以准确测量最大呼吸,获得正值备用呼吸能力,从而有助于准确检测脂肪细胞不同分化阶段的底物依赖性。
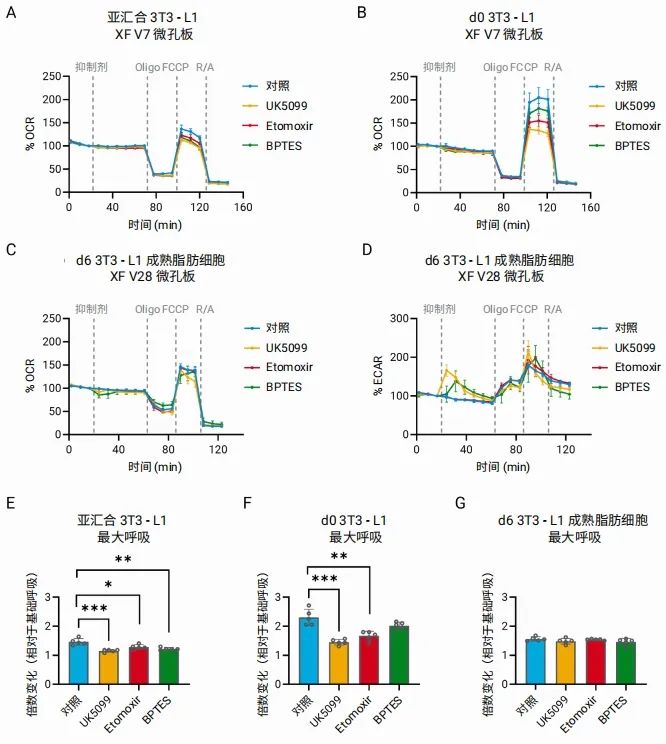
图 7. 对成熟前和成熟 3T3-L1 脂肪细胞进行 Seahorse XF 底物氧化压力测试。亚汇合 3T3-L1 成纤维细胞 (A)、d0 前脂肪细胞 (B) 和 d6 3T3-L1 脂肪细胞 (C) 以第 3 次测量为基线的 OCR 动力学曲线。(D) d6 3T3-L1 成熟脂肪细胞以第 3 次测量为基线的 ECAR 动力学曲线。(E–G) 亚汇合 3T3-L1 成纤维细胞、d0 L1 前脂肪细胞和 d6 3T3-L1 脂肪细胞的最大呼吸(相对于基础呼吸)。2 次独立实验的代表性数据。数据代表 5 个技术重复样本的平均值 ± SD。*P<0.05 ,**P<0.01 ,***p<0.001
结论
细胞分化过程中的代谢重编程对决定细胞谱系定向至关重要,相关研究结果可为优化分化方案提供重要依据。此外,它还有助于我们深入理解影响分化细胞功能的基因扰动机制,从而指导治疗药物开发。由于分化过程中生物能量代谢会发生剧烈变化,建立合适的检测条件对于准确测定分化过程中不同阶段的线粒体活性非常重要。安捷伦 Seahorse XF Flex 分析仪为在脂肪细胞分化的整个过程中准确评估线粒体功能提供了优化的工作流程。该工作流程无需调整分化方案或时间框架即可准确检测代谢,从而为细胞代谢及其调控提供新的见解。
更多详细内容
扫码下载该应用方案查看

参考文献
1. Das, S.; Mukhuty, A.; Mullen, G. P.; Rudolph, M. C. Adipocyte Mitochondria: Deciphering Energetic Functions across Fat Depots in Obesity and Type 2 Diabetes. Int J Mol Sci 2024, 25(12). DOI: 10.3390/ijms25126681 From NLM Medline
2. Koliaki, C.; Roden, M. Alterations of Mitochondrial Function and Insulin Sensitivity in Human Obesity and Diabetes Mellitus. Annu Rev Nutr 2016, 36, 337-367. DOI: 10.1146/ annurev-nutr-071715-050656 From NLM Medline
3. Morrison, S.; McGee, S. L. 3T3-L1 Adipocytes Display Phenotypic Characteristics of Multiple Adipocyte Lineages. Adipocyte 2015, 4(4), 295-302. DOI:10.1080/21623945.2015.1040612 From NLM PubMed- not-MEDLINE
4. Bernlohr, D. A.; Bolanowski, M. A.; Kelly, T. J., Jr.; Lane, M.D. Evidence for an Increase in Transcription of Specific mRNAs During Differentiation of 3T3-L1 Pre-adipocytes. J Biol Chem 1985, 260(9), 5563-5567. DOI: 10.1016/S0021-9258(18)89059-7 From NLM Medline
关于安捷伦细胞分析
安捷伦细胞分析平台包括xCELLigence RTCA实时细胞分析仪、Novocyte系列流式细胞仪、Seahorse能量代谢分析仪以及Synergy系列微孔板检测仪和Cytation 系列(共聚焦)细胞成像多功能微孔板检测仪。安捷伦细胞分析平台聚焦基础科研与细胞与基因治疗产品的开发全流程,作为适配新一代疗法的强大分析工具,提供多方位的细胞效力检测和深度的细胞分析,并致力于研发、生产质控以及临床的全方位检测与分析方案开发。

扫描二维码,关注安捷伦细胞分析






