推荐产品
公司新闻/正文
临床新视角 | 流式细胞术检测外周血免疫细胞线粒体膜电位
511 人阅读发布时间:2025-10-22 10:27
线粒体作为细胞的“能量工厂”,其功能状态对免疫细胞的活性和功能至关重要。线粒体膜电位(Mitochondrial Membrane Potential, MMP)是评估线粒体功能的核心指标之一。流式细胞术作为一种高效、精准的检测技术,能够快速、定量地分析外周血免疫细胞的 MMP,为免疫相关疾病的研究和临床诊断提供了重要工具。本文将重点介绍流式细胞术在外周血免疫细胞 MMP 检测中的应用及其临床意义。
一 线粒体膜电位与免疫细胞功能
免疫细胞(如 T 细胞、B 细胞、NK 细胞等)的活化、增殖和效应功能高度依赖线粒体能量代谢。MMP 的变化直接影响免疫细胞的功能状态,抑制线粒体膜电位改变防止淋巴细胞在体外被诱导死亡。健康个体 CD4+T 细胞的线粒体膜电位高于 CD8+T 细胞,记忆 T 细胞中具有更高的线粒体膜电位。
因此,检测外周血免疫细胞的 MMP,可以评估免疫细胞的功能状态,为免疫相关疾病的机制研究和临床诊断提供重要信息。
二 流式细胞术检测外周血免疫细胞 MMP 的方法
流式细胞术通过荧光染料标记线粒体,结合细胞表面标志物(如 CD3、CD4、CD8 等),能够特异性地分析不同免疫细胞亚群的 MMP。以下是常用的实验步骤:
01 样本制备
采集抗凝外周血样本。
02 荧光染色
使用 MMP 特异性荧光染料(如 JC-1)孵育细胞。
03 表面标志物标记
加入免疫细胞表面标志物的荧光抗体(如 CD3-APC Fire750、CD4-APC 等)。
04 流式检测及数据分析
通过流式细胞仪分析不同免疫细胞亚群的 MMP,利用流式分析软件定量比较不同细胞群的 MMP 变化。
三 流式细胞术检测外周血免疫细胞 MMP 的临床应用
1. 自身免疫病诊断与疾病活动度与治疗评估
1) 系统性红斑狼疮(SLE)
系统性红斑狼疮(SLE)是一种慢性炎症性疾病,伴有 T 和 B 淋巴细胞信号传导异常以及抗核自身抗体的产生。患者的外周血淋巴细胞(PBL)表现出自发性激活增加和诱导的细胞凋亡减少。线粒体超极化和由此产生的 ATP 耗竭使 T 细胞对坏死敏感,这可能显著导致 SLE 患者的炎症。
SLE 患者的 CD3+CD4+T 细胞、CD3+CD8+T 细胞且其各个亚群 MMP 降低的比例显著低于健康人对照,因此 MMP 水平与疾病活动度相关,可作为 SLE 诊断和疾病活动度监测的潜在生物标志物。
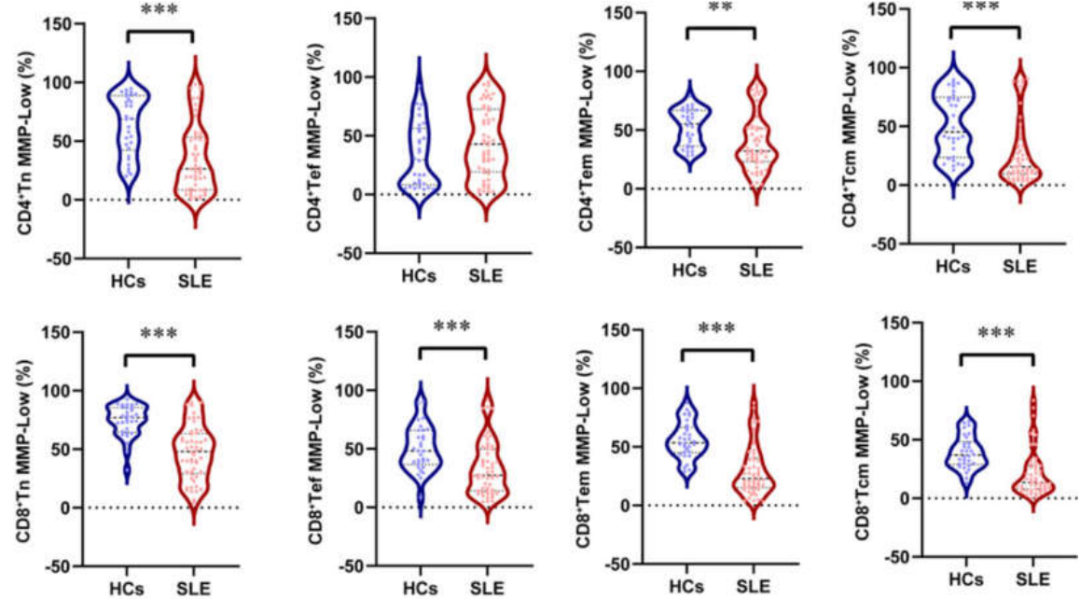
图 1. 健康对照(n = 30)和 SLE 患者(n = 52)各 T 细胞亚群的 MMP 对比[4]
2) 类风湿性关节炎(RA)
类风湿性关节炎(RA)是一种全身性和慢性炎症性疾病,具有自身免疫反应和炎症,导致骨骼和关节破坏。RA 患者的免疫细胞中存在功能失调的线粒体,膜电位、ATP 生成和线粒体超氧化物水平降低。
3) 原发性干燥综合征(pSS)
中性粒细胞外捕获网(NETs)是中性粒细胞的第二种杀菌机制,在其凋亡或坏死后可以继续履行捕获病原体的功能。尽管 NETs 在免疫防御中发挥了重要作用,但过度或不适当的 NETs 释放也与多种疾病有关,包括自身免疫性疾病、血栓性疾病等。pSS 患者单核细胞的低线粒体膜电位细胞相比健康对照比例更高,线粒体损伤是 NETs 形式的依赖条件,从而导致 pSS 的炎症表现。
4) 免疫性血小板减少症(ITP)
免疫性血小板减少症(ITP)是一种自身免疫性疾病,其中血小板自身抗原导致免疫介导的血小板破坏和/或抑制血小板生成。ITP 患者血小板线粒体膜电位下降的细胞比例大于健康对照,显示凋亡增加且自噬减少。血小板自噬升高可能通过抑制血小板凋亡和提高血小板活力来延长 ITP 患者血小板的寿命。
2. 感染性疾病诊断与监测
1) HIV
未经治疗的 HIV 感染者 PBMC 线粒体膜电位显著降低, PBMC 线粒体膜电位高低与 CD4+T 细胞计数呈正相关,与 HIV 病毒载量呈负相关。HIV 感染者的 CD8+T 细胞和 CD4+T 细胞线粒体功能受损,表现为 MMP 降低、线粒体质量减少和活性氧(ROS)水平升高。接受抗逆转录病毒治疗(ART)后,未接受过治疗的患者其 PBMC 的线粒体膜电位显著增加,提示 MMP 可作为评估 HIV 感染者 T 细胞功能耗竭和免疫重建潜力的生物标志物,指导抗逆转录病毒治疗(ART)的优化。
2) 慢性乙型肝炎(HBV)和丙型肝炎(HCV)
慢性 HBV 感染者的衰老或受损 CD8+T 细胞,包括病毒特异性 CD8+T 细胞 MMP 显著降低,导致 T 细胞功能耗竭。提示通过恢复 T 细胞线粒体功能(如使用线粒体靶向药物),可能增强抗病毒免疫反应,为慢性肝炎的治疗提供新策略。
HBV 感染致肝硬化患者的 CD8+T 细胞和 CD56+NK 细胞线粒体膜电位降低的细胞比例相比健康人和慢性乙肝患者显著降低,原因可能是随着 HBV 感染的进展,抗原特异性淋巴细胞被持续激活,反映为 CD8+T 和 NK 细胞线粒体膜电位的持续增加,可将其作为区分肝硬化和慢性乙肝的潜在指标。
将慢性乙肝患者根据B超结果分为炎症组和非炎症组,发现炎症患者的淋巴细胞,主要是 CD8+T 细胞、CD56+NK 细胞,CD4-CD8-T 细胞具有高膜电位,促进炎症因子的合成和释放,并引起炎症,这些细胞亚群的线粒体膜电位情况对早期肝脏炎症具有诊断价值。
与健康受试者相比,慢性 HCV 感染患者的记忆细胞(CD45RA-)、非循环细胞(CD71-) 和非循环记忆 (CD71-CD45RA-) 等 CD4+T 细胞亚群线粒体染料标记细胞显著增加,提示在 HCV 感染期间,CD4+T 细胞亚群的 ROS 产生增加和线粒体膜电位受损。
3) COVID-19
COVID-19 感染会诱导成人 CD3 淋巴细胞的线粒体膜电位下降,但在儿童患者中影响不显著。线粒体损伤引起的细胞凋亡与疾病严重程度相关。
4) 脓毒症
在败血症患者的 PBMC 中可以观察到线粒体膜电位改变和随后的细胞死亡。重症脓毒症开始后 72 小时内的时间点 T1,重症脓毒症发作后 7 至 10 天内的时间点 T2,幸存者出院时的时间点 T3 进行检测,观察到脓毒症患者在 T1 和 T2 的去极化线粒体细胞百分比增加。然而,在出院时 (T3) 恢复到对照值。非幸存者脓毒症患者 ΔΨm 的变化比幸存者更明显,表明线粒体膜电位是疾病结局的标志物。
3. 代谢性疾病
1) 2 型糖尿病
2 型糖尿病患者的外周血淋巴及单核细胞的线粒体膜电位有更高的去极化,但 CD8+T 细胞和单核细胞 MMP 显著降低,线粒体功能受损与胰岛素抵抗和疾病进展相关。提示 T 细胞中 MMP 可作为评估糖尿病患者免疫代谢状态和并发症风险的指标,为个性化治疗提供依据。
2) 糖尿病肾病
糖尿病肾病患者的外周血淋巴及单核细胞线粒体功能受损,MMP 降低与疾病进展相关。提示通过改善线粒体功能,可能延缓糖尿病肾病的进展。
4. 肿瘤及肿瘤治疗
1) 多发性骨髓瘤
多发性骨髓瘤患者的 T 细胞线粒体功能受损,表现为 MMP 降低和代谢功能障碍。 MMP 可作为评估肿瘤患者 T 细胞衰老和免疫治疗效果的指标。
2) 肿瘤免疫治疗
肿瘤微环境常导致免疫细胞功能耗竭,线粒体功能障碍是重要机制之一。通过检测肿瘤患者外周血 T 细胞、NK 细胞的 MMP,可以评估免疫细胞的功能状态,为免疫治疗(如 CAR-T 细胞疗法、PD-1 抑制剂)的效果提供参考。通过药物增强T细胞线粒体膜电位可能提高抗 PD-1 治疗的反应性。
在细胞治疗中,尤其是过继性细胞治疗(ACT)中,选择具有高效能和长期存活能力的免疫细胞至关重要。免疫细胞的线粒体膜电位是细胞代谢状态和功能的重要指标。研究表明,线粒体膜电位较低的免疫细胞表现出更强的干细胞特性和长期存活能力,这些特性使得它们更适合用于细胞治疗。
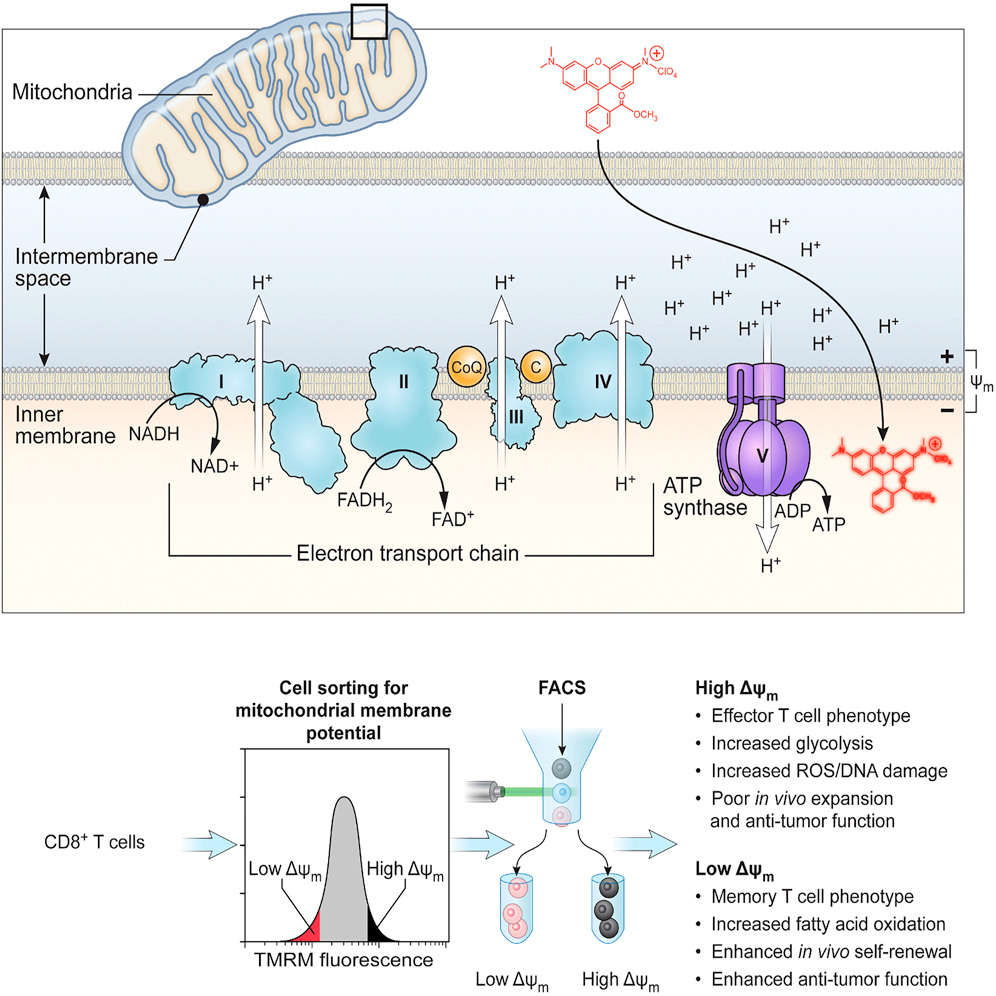
图 2. 低膜电位 CD8+T 细胞显示出更强的抗肿瘤活性[5]
5. 心血管疾病
1) 动脉粥样硬化
线粒体膜电位低的循环单核细胞,与慢性炎症和动脉粥样硬化的发展相关。具有较高比例低膜电位单核细胞的患者群体,其斑块评分更高。
2) 冠心病
急性冠脉综合征(ACS)和稳定性冠状动脉疾病(CAD)患者中,单核细胞-血小板聚集体的形成是将血栓形成与炎症关联的关键步骤。研究表明此类患者的单核细胞-血小板聚集体线粒体膜电位升高。
3) 慢性心力衰竭(CHF)
慢性心力衰竭 (CHF) 患者存在严重的功能限制,频繁反复住院,五年死亡率为 50%, 越来越多的证据表明,外周血淋巴细胞发生的变化类似于心力衰竭中衰竭的心肌细胞,如淋巴细胞计数与心理衰竭的预后相关,且 CHF 患者淋巴细胞 MMP 较低,是患者再入院的独立预测因子。
6. 衰老
1) 免疫细胞衰老
人 CD4+T 和 CD8+T 细胞对衰老的易感性不同,CD8+T 细胞获得免疫衰老表型的速度比 CD4+T 细胞更快。研究发现,CD4 EMRA 亚群超极化线粒体比例高于 CD8 EMRA 亚群,后者显示出低极化表型。提示线粒体膜电位可能是细胞抵抗免疫衰老的机制之一。
2) 肌肉减少症
肌肉减少症指与年龄相关的骨骼肌治疗下降,在老年人中,与多种不良健康结果相关,随着世界人口老龄化,该疾病越来越受到关注。外周血 PBMC 中富含线粒体,随着年龄增长,线粒体因为各种机制容易受到结构损伤和功能障碍,线粒体的去极化,即膜电位降低在肌肉减少症受试者中显著增加。线粒体损伤后释放到循环的 mtDNA 可能是肌肉减少症相关的炎症刺激来源,可以作为改善这种疾病的治疗靶点。
7. 外科手术
手术应激会导致全身免疫反应受损,可能会促进癌症患者对感染的易感性以及残余癌细胞的生长。外周血淋巴细胞的线粒体膜电位,尤其是 NK 细胞的线粒体膜电位在大手术后减少,且与手术的严重程度成正比,反映了细胞功能的损害。且 NK 细胞线粒体膜电位的降低与血浆去甲肾上/腺素水平呈负相关,提示术后外周血淋巴细胞线粒体膜电位是评估手术应激程度的有用标志之一。
四 流式细胞术检测 MMP 的优势
01 高特异性
结合表面标志物,可精确分析不同免疫细胞亚群的 MMP。
02 高通量
可同时分析数千个细胞,快速获得统计学可靠的数据。
03 多参数分析
可结合其他细胞状态和功能标志物,全面评估免疫细胞状态。
04 临床适用性强
外周血样本易于获取,适合临床研究和诊断。
结语
流式细胞术检测外周血免疫细胞线粒体膜电位,为免疫相关疾病的研究和临床诊断提供了强有力的工具。通过评估免疫细胞的能量状态,我们可以更深入地了解疾病的机制,监测疾病进展和预后,并开发更精准的治疗策略。随着流式细胞术技术的不断进步,其在免疫细胞 MMP 检测中的应用将更加广泛。
注:该内容为知识科普,不涉及医疗器械广告
参考文献
1. M’Bemba-Meka, P., Lemieux, N. & Chakrabarti, S.K. Role of oxidative stress, mitochondrial membrane potential, and calcium homeostasis in human lymphocyte death induced by nickel carbonate hydroxide in vitro. Arch Toxicol 80, 405–420 (2006).
2. Korolevskaya, L.B., Saidakova, E.V., Shmagel, N.G. et al. Assessment of the Mitochondrial Condition in CD4+ and CD8+ T-Lymphocytes from Healthy Subjects. Cell Tiss. Biol. 16, 470–477 (2022).
3. Gergely P Jr, Grossman C, Niland B, Puskas F, Neupane H, Allam F, Banki K, Phillips PE, Perl A. Mitochondrial hyperpolarization and ATP depletion in patients with systemic lupus erythematosus. Arthritis Rheum. 2002 Jan;46(1):175-90.
4. Zhao G, Li H, Miao Y, Cheng L, Chen Y, Huang Y, Zhao H, Liu Y, Jing Y, Wang S, Li Y and Zhang R (2025) Mitochondrial mass and mitochondrial membrane potential of peripheral lymphocytes: promising biomarkers of systemic lupus erythematosus. Front. Mol. Biosci. 12:1585847. doi: 10.3389/fmolb.2025.1585847
5. Madhusudhanan Sukumar...Nicholas P. Restifo et.al, Mitochondrial Membrane Potential Identifies Cells with Enhanced Stemness for Cellular Therapy, Cell Metabolism, Volume 23, Issue 1,2016,Pages 63-76.
6. Deguit CDT, Hough M, et.al. Some Aspects of CD8+ T-Cell Exhaustion Are Associated With Altered T-Cell Mitochondrial Features and ROS Content in HIV Infection. J Acquir Immune Defic Syndr. 2019 Oct 1;82(2):211-219.
7. Cooke RE, Quinn KM, et.al. Conventional Treatment for Multiple Myeloma Drives Premature Aging Phenotypes and Metabolic Dysfunction in T Cells. Front Immunol. 2020 Sep 3;11:2153.
8. Chen J, Chernatynskaya AV, Li JW, Kimbrell MR, Cassidy RJ, Perry DJ, Muir AB, Atkinson MA, Brusko TM, Mathews CE. T cells display mitochondria hyperpolarization in human type 1 diabetes. Sci Rep. 2017 Sep 7;7(1):10835. doi: 10.1038/s41598-017-11056-9. PMID: 28883439; PMCID: PMC5589742.
9. Anupam K, Kaushal J, Prabhakar N, Bhatnagar A. Effect of redox status of peripheral blood on immune signature of circulating regulatory and cytotoxic T cells in streptozotocin induced rodent model of type I diabetes. Immunobiology. 2018 Oct;223(10):586-597. doi: 10.1016/j.imbio.2018.07.004. Epub 2018 Jul 7. PMID: 30017263.
10. Ruiz-Limon P , Barbarroja N , Perez-Sanchez C ,et al.Atherosclerosis and cardiovascular disease in systemic lupus erythematosus: effects of in vivo statin treatment.[J].Annals of the Rheumatic Diseases, 2015, 74(7):1450-8.DOI:10.1136/annrheumdis-2013-204351.
11. Leishangthem B D , Sharma A , Bhatnagar A .Role of altered mitochondria functions in the pathogenesis of systemic lupus erythematosus[J].Lupus, 2016:0961203315605370.
12. Khanna S , Padhan P , Jaiswal K S ,et al. Altered mitochondrial proteome and functional dynamics in patients with rheumatoid arthritis [J].Mitochondrion, 2020, 54.DOI:10.1016/j.mito.2020.06.005.
13. Schank M , Zhao J , Wang L ,et al. Oxidative Stress Induces Mitochondrial Compromise in CD4 T Cells From Chronically HCV-Infected Individuals[J].Frontiers in immunology, 2021, 12:760707.DOI:10.3389/fimmu.2021.760707.
14. Fisicaro P , Barili V , Montanini B ,et al. Targeting mitochondrial dysfunction can restore antiviral activity of exhausted HBV-specific CD8 T cells in chronic hepatitis B[J].Nature Medicine, 2017, 23(3):327.DOI:10.1038/nm.4275.
15. Deguit CDT, Hough M, Hoh R, Krone M, Pilcher CD, Martin JN, Deeks SG, McCune JM, Hunt PW, Rutishauser RL. Some Aspects of CD8+ T-Cell Exhaustion Are Associated With Altered T-Cell Mitochondrial Features and ROS Content in HIV Infection. J Acquir Immune Defic Syndr. 2019 Oct 1;82(2):211-219. doi: 10.1097/QAI.0000000000002121. PMID: 31513075; PMCID: PMC6746248.
16. Yu F, Hao Y, Zhao H, Xiao J, Han N, Zhang Y, Dai G, Chong X, Zeng H, Zhang F. Distinct Mitochondrial Disturbance in CD4+T and CD8+T Cells From HIV-Infected Patients. J Acquir Immune Defic Syndr. 2017 Feb 1;74(2):206-212. doi: 10.1097/QAI.0000000000001175. PMID: 27608061.
17. Siska PJ, Beckermann KE, Mason FM, Andrejeva G, Greenplate AR, Sendor AB, Chiang YJ, Corona AL, Gemta LF, Vincent BG, Wang RC, Kim B, Hong J, Chen CL, Bullock TN, Irish JM, Rathmell WK, Rathmell JC. Mitochondrial dysregulation and glycolytic insufficiency functionally impair CD8 T cells infiltrating human renal cell carcinoma. JCI Insight. 2017 Jun 15;2(12):e93411. doi: 10.1172/jci.insight.93411. PMID: 28614802; PMCID: PMC5470888.
18. Yu, YR., Imrichova, H., Wang, H. et al. Disturbed mitochondrial dynamics in CD8+ TILs reinforce T cell exhaustion. Nat Immunol 21, 1540–1551 (2020).
19. Callender LA, Carroll EC, Garrod-Ketchley C, Schroth J, Bystrom J, Berryman V, Pattrick M, Campbell-Richards D, Hood GA, Hitman GA, Finer S and Henson SM (2021) Altered Nutrient Uptake Causes Mitochondrial Dysfunction in Senescent CD8+ EMRA T Cells During Type 2 Diabetes. Front. Aging 2:681428. doi: 10.3389/fragi.2021.681428
20. Jiang H, Shao X, Jia S, Qu L, Weng C, Shen X, Wang Y, Huang H, Wang Y, Wang C, Feng S, Wang M, Feng H, Geekiyanage S, Davidson AJ, Chen J. The Mitochondria-Targeted Metabolic Tubular Injury in Diabetic Kidney Disease. Cell Physiol Biochem. 2019;52(2):156-171. doi: 10.33594/000000011. Epub 2019 Feb 28. PMID: 30816665.
21. Callender LA, Carroll EC, Bober EA, Akbar AN, Solito E, Henson SM. Mitochondrial mass governs the extent of human T cell senescence. Aging Cell. 2020 Feb;19(2):e13067. doi: 10.1111/acel.13067. Epub 2019 Dec 2. PMID: 31788930; PMCID: PMC6996952.
22. Sternfeld T, Tischleder A, Schuster M, Bogner JR. Mitochondrial membrane potential and apoptosis of blood mononuclear cells in untreated HIV-1 infected patients. HIV Med. 2009 Sep;10(8):512-9. doi: 10.1111/j.1468-1293.2009.00723.x. Epub 2009 Jun 1. PMID: 19496834.
23. Sternfeld T, Schmid M, Tischleder A, Mudra S, Schlamp A, Kost BP, Gruber R, Youle M, Bogner JR, Goebel FD. The influence of HIV infection and antiretroviral therapy on the mitochondrial membrane potential of peripheral mononuclear cells. Antivir Ther. 2007;12(5):769-78. PMID: 17713160.
24. Ma L, Han Q, Cheng L, Song H, Qiang R, Xu P, Gao F, Zhu L, Xu J. Altered mitochondrial mass and low mitochondrial membrane potential of immune cells in patients with HBV infection and correlation with liver inflammation. Front Immunol. 2024 Nov 22;15:1477646. doi: 10.3389/fimmu.2024.1477646. PMID: 39650657; PMCID: PMC11621101.
25. Yang Yang, Liangjian Kuang, Linhai Li, Yongjian Wu, Bei Zhong, Xi Huang, Distinct Mitochondria-Mediated T-Cell Apoptosis Responses in Children and Adults With Coronavirus Disease 2019, The Journal of Infectious Diseases, Volume 224, Issue 8, 15 October 2021, Pages 1333–1344
26. Widlansky ME, Wang J, Shenouda SM, Hagen TM, Smith AR, Kizhakekuttu TJ, Kluge MA, Weihrauch D, Gutterman DD, Vita JA. Altered mitochondrial membrane potential, mass, and morphology in the mononuclear cells of humans with type 2 diabetes. Transl Res. 2010 Jul;156(1):15-25. doi: 10.1016/j.trsl.2010.04.001. Epub 2010 May 11. PMID: 20621033; PMCID: PMC2904361.
27. Vogel, Sebastian et al. Elevated mitochondrial membrane potential of circulating monocyte–platelet aggregates in patients with coronary heart disease International Journal of Cardiology, Volume 181, 135 – 137
28. Song, Bingxue et al. Correlations between MTP and ROS Levels of Peripheral Blood Lymphocytes and Readmission in Patients with Chronic Heart Failure Heart, Lung and Circulation, Volume 25, Issue 3, 296 - 302
29. Peng, Y., Wu, X., Zhang, S. et al. The potential roles of type I interferon activated neutrophils and neutrophil extracellular traps (NETs) in the pathogenesis of primary Sjögren’s syndrome. Arthritis Res Ther 24, 170 (2022).
30. Zhen Fan, Jing-yu Yang, Yi Guo, Yao-xia Liu, Xiao-yi Zhong, Altered levels of circulating mitochondrial DNA in elderly people with sarcopenia: Association with mitochondrial impairment, Experimental Gerontology, Volume 163, 2022, 111802, ISSN 0531-5565;
31. Wang CY, Ma S, Bi SJ, Su L, Huang SY, Miao JY, Ma CH, Gao CJ, Hou M, Peng J. Enhancing autophagy protects platelets in immune thrombocytopenia patients. Ann Transl Med. 2019 Apr;7(7):134. doi: 10.21037/atm.2019.03.04. PMID: 31157255; PMCID: PMC6511561.
文章来源:安捷伦细胞分析公众号
关于安捷伦细胞分析
安捷伦细胞分析平台包括xCELLigence RTCA实时细胞分析仪、Novocyte系列流式细胞仪、Seahorse能量代谢分析仪以及Synergy系列微孔板检测仪和Cytation 系列(共聚焦)细胞成像多功能微孔板检测仪。安捷伦细胞分析平台聚焦基础科研与细胞与基因治疗产品的开发全流程,作为适配新一代疗法的强大分析工具,提供多方位的细胞效力检测和深度的细胞分析,并致力于研发、生产质控以及临床的全方位检测与分析方案开发。

扫描二维码,关注安捷伦细胞分析






